Темное пятно на экране ЖК телевизора
Почему появляются пятна на телевизоре? Есть несколько причин. Каждую из них детально рассмотрим, а потом проанализируем проверенные способы устранения подобных дефектов. Чтобы избежать появления затемнений, черных и цветных пятен, полос, соблюдайте условия эксплуатации техники.
Многие пользователи не уделяют должного внимания уходу за жидкокристаллическим экраном. Необходимо протирать дисплей телевизора хотя бы несколько раз в месяц. Такая превентивная мера позволит избежать появления различных дефектов.
Избирательным нужно быть в вопросе чистящих средств. Например, нельзя использовать косметические влажные салфетки, средства на основе спирта, не предназначенные для ухода за ЖК экраном. Сейчас же перейдем к рассмотрению основных причин появления пятен на дисплее.
Заводской брак
Если экран работает, но при этом появилось яркое свечение, то это первый признак, свидетельствующий о производственном браке. Матрица неисправна. Если на телевизор еще действует гарантия, то лучше его обменять. Поскольку ремонт – слишком дорогостоящее удовольствие.
Если на телевизор еще действует гарантия, то лучше его обменять. Поскольку ремонт – слишком дорогостоящее удовольствие.
Дефект проявляется не сразу. Яркое свечение возникает после неоднократного нагрева. Специфика поломки заключается в том, что нарушена геометрия слоев матрицы. Причиной неисправности стала неправильная установка рассеивателя и отражателя.
Если на экране появилось темное пятно, то это также может говорить о производственном браке. Сначала дефект проявляется в виде незначительных точек. Такой симптом свидетельствует о несоблюдении на производстве технологии установки экрана.
Небольшие белые пятна на экране телевизора со временем постепенно темнеют, а также увеличиваются их масштабы. Обратитесь в сервис-центр, чтобы мастера починили неисправное устройство или поменяли поврежденную матрицу.
Что делать, если срок гарантия завершился? Если вы пользуетесь телевизором от именитого бренда: Samsung, Sony, LG, то не исключено, что компания захочет сохранить свою репутацию и пойдет вам навстречу. Однако такой сценарий возможен только при условии, что не было механических повреждений ТВ и соблюдались правила ухода за техникой.
Однако такой сценарий возможен только при условии, что не было механических повреждений ТВ и соблюдались правила ухода за техникой.
Отдельно стоит поговорить о наличии программного обеспечения для восстановления битых пикселей. Впрочем, использование специального софта будет оправдано в только в том случае, если не повреждены субпиксели.
Пыль и мелкий мусор
Белые пятна на экране ЖК телевизора возникают в результате проникновения частиц пыли в слои матрицы. Это также свидетельствует о несоблюдении геометрии слоев. Регулярные температурные колебания (телевизор постоянно нагревается, а потом остывает) приводят к движению слоев. Из-за этого в слои матрицы попадает пыль и другой мелкий мусор. Спустя 2-3 месяца могут появиться черные точки или большое черное пятно.
Эксперты настоятельно рекомендуют своевременно протирать жидкокристаллический дисплей. Необязательно использовать специальные влажные салфетки или специальные аэрозоли. Оптимальный способ устранения пыли – продувка.
Это исключает вероятность появления повреждений на матрице.
Не только пыль может застрять между слоев матрицы. Не исключено, что там окажутся и более крупные частицы. Встречаются случаи, когда между слоями застревают насекомые. Впрочем, это скорее исключение, свидетельствующее о заводском браке.
Крупные частицы пыли, и другие загрязнения удаляются следующим образом:
- Возьмите сухую и мягкую тряпку.
- Легко постукивайте по дисплею.
- Частицы пыли будут постепенно отпадать.
Почему нельзя просто протереть экран? Во-первых, могут появиться разводы, от которых чрезвычайно сложно избавиться в дальнейшем. Во-вторых, если геометрия слоев действительно нарушена, то протирание только усугубит проблему.
Чтобы пыль не застряла между слоев LED телевизора, нужно легонько стучать по центру дисплея. Постукивания по краям могут усугубить проблему.
Пятная от удара
Темные пятна на телевизоре – следы механического повреждения. Такие дефекты появляются в том случае, если ТВ-устройство упало или произошел удар дисплея, сильное механическое воздействие. Пятна имеют очень четкие контуры.
Такие дефекты появляются в том случае, если ТВ-устройство упало или произошел удар дисплея, сильное механическое воздействие. Пятна имеют очень четкие контуры.
Внутренний нагрев телевизора усугубляет поломку. Поскольку соседние пиксели также повреждаются. Починить дисплей телевизора Самсунг или LG невозможно, обратитесь в сервис-центр, чтобы мастера поменяли матрицу. Впрочем, это тоже финансово затратная процедура.
Если на экране плазмы или ЖК телевизора появились темные пятна, вызванные механическим повреждением, рациональней купить новую технику. Ремонт обойдется примерно в 50% номинальной стоимости ТВ.
Пятна от жидкости
Отличить пятно на экране телевизора, вызванное попаданием обильного количества жидкости от затемнения, которое появилось из-за пыли, чрезвычайно просто. Дефекты появляются, если на дисплей попал алкоголь, чай, кофе, сок или самая обычная вода.
Что делать, если на дисплее образовалось такое пятна? Промойте экран кипяченой воду (комнатной температуры) или очищенным спиртом.
Устраняются пятна, которые появились из-за жидкости, в комнате без пыли и сквозняков. Обязательно промывайте дисплей в перчатках, чтобы не усугубить поломку.
Темные полукруглые пятна по краям
Темное пятно на экране ЖК телевизора свидетельствует о поломке элементов светодиодной подсветки. Это локальное затемнение. Дефекты такого типа появляются в углу экрана. Устраняется неисправность путем замены перегоревшего светодиода.
Если ранее разборка телевизора не проводилась, а также не закончился гарантийный срок, тогда замена неисправных элементов светодиодной подсветки будет осуществлена бесплатно.
Как избавиться от пятен
Основные способы ухода за жидкокристаллическим экраном были рассмотрены ранее. Мы предложили несколько действенных способов, направленных на исправление конкретных дефектов. Есть и другие хитрости, позволяющие удалить пятна, которыми мы поделимся с вами:
- Если пятно появилось в результате механического повреждения, то устранить его не удастся.
 Единственный выход – замена поврежденных комплектующих.
Единственный выход – замена поврежденных комплектующих. - Потекшая матрица – еще один признак того, что восстановить аппаратный модуль не удастся. Если гарантия не закончилась, тогда ремонт телевизора будет проведен бесплатно.
- Что делать, если пыль уже просочилась между слоями матрицы, а обычные постукивания по экрану не дают результата? Купите специальную салфетку для ЖК дисплеев, сделанную из микрофибры, а также приобретите аэрозоль для очистки экрана. Распылите аэрозоль на салфетку, а потом протрите телевизор.
- Если ТВ был залит жидкостью, то на гарантийный ремонт надеется не стоит. Впрочем, можно самостоятельно промыть экран. Смешайте уксус, кипяченую воду и очищенный спирт, а потом протрите дисплей, используя мягкую сухую салфетку (желательно из микрофибры).
- Продувать слои матрицы можно с помощью бытовой техники. Многие пылесосы оснащены подходящими для этой процедуры насадками. Главное, не подносите слишком близко насадку к экрану. Продув осуществляется на дистанции.

Теперь вы знаете, как убрать появившиеся на экране пятна самостоятельно. Далеко не всегда можно решить проблему, используя подручные средства. Например, если дефект появился из-за механического повреждения или перегорела светодиодная подсветка, тогда обратитесь за помощью к специалистам.
Темные пятна на экране телевизора (ЖК, LED, плазменном, кинескопном)
Одной из распространенных неисправностей на ТВ выступают темные пятна на телевизоре. В зависимости от степени повреждения экрана пятнышки могут полностью перекрывать изображение. Это касается образования больших черных областей, а также многочисленных пятен небольшого размера. На практике такие дефекты самостоятельно не пропадают. В данном случае потребуется профессиональный ремонт. Он может коснуться как замены недорогих комплектующих, так и установки новой матрицы. Узнать точные виды работ и стоимость восстановления можно после проведения диагностики специалистами нашей компании.
Это касается образования больших черных областей, а также многочисленных пятен небольшого размера. На практике такие дефекты самостоятельно не пропадают. В данном случае потребуется профессиональный ремонт. Он может коснуться как замены недорогих комплектующих, так и установки новой матрицы. Узнать точные виды работ и стоимость восстановления можно после проведения диагностики специалистами нашей компании.
Заказать ремонт телевизоров в Москве, СПб и областях можно по телефонному номеру 8(495)228-33-48 или онлайн на сайте. Ремонтные работы проводят на дому у клиента. Запчасти для распространенных брендов, включая Samsung, LG, всегда есть в наличии. Предоставляем профессиональные услуги ежедневно с 8:00 до 23:00, включая выходные, праздники.
Визуальные признаки
Темные пятна на экране телевизора определяются довольно легко. Их видно на светлом экране и при просмотре видеороликов. Могут иметь совершенно любую форму. Бывают овальными, круглыми, продолговатыми, неправильной формы. Образовываются в любом месте: в углу, центре, по краям. Количество зависит от степени повреждения.
Образовываются в любом месте: в углу, центре, по краям. Количество зависит от степени повреждения.
Причины неисправностей зависят от типа экрана. Но важно понимать, что речь идет о темных пятнах, которые имеют относительно большие размеры. Если вас интересует устранение битых пикселей, которые не работают, ознакомьтесь с нашими другими статьями или свяжитесь с операторами.
Возможные причины неисправности
ЖК, LED модели
Когда появилось темное пятно на телевизоре ЖК или LED, нужно провести диагностику. Особенно важно это сделать, если техника находится на гарантии, так как на жидкокристаллических приборах чаще всего требуется замена матрицы.
Основными причинами выступают:
- Серьезные удары, падения аппарата.
- Оказание сильного давления на экран, нарушение правил транспортировки.
- Другие типы повреждений.
Нередко встречается заводской брак. При его наличии выполняется гарантийный ремонт в сервисном центре производителя или возвращается прибор обратно продавцу.
Плазменные матрицы
Причинами выступают механические повреждения, дефекты при сборке на заводе и многое другое. Но в отличие от современных технологий в «плазмах» темные пятна образовываются и при других обстоятельствах:
- Выход из строя блоков, строящих изображение.
- Обрыв, окисление контактов после попадания влаги.
- Износ деталей питания.
В данном случае возможно выполнение недорого ремонта без замены матрицы. Все необходимые детали есть на нашем складе, в том числе для брендов Sony, Philips.
Кинескопные приборы
Основная причина образования пятнышек темного цвета на кинескопах заключается в старости оборудования. При длительной эксплуатации на внутренней поверхности осыпается люминофор, что приводит к визуальной поломке. Восстановление требует замены кинескопа на новый. Чаще из-за старости, неактуальности выгоднее купить новый телевизор.
Самостоятельный ремонт
При отсутствии опыта, специализированного инструмента ремонт своими руками не допускается. Это приводит к:
- Серьезным повреждениям корпуса и внутренних комплектующих.
- Проблемам в смежных узлах, деталях, не влияющих на образование пятен.
- Травмам, ударам током, смертельно-опасным ситуациям, включая короткие замыкания, возгорание техники.
Помните, что ТВ оборудование работает от сети 220В, включает в конструкцию сложные комплектующие, включая узлы с повышенным напряжением. Не рискуйте, выбирайте услуги сервисного центра «Аккуратный дом». Восстановим устройство на дому с предоставлением официальной гарантии.
Как убрать засвет (белые пятна) на ЖК телевизоре?
Как убрать засвет (белые пятна) на ЖК телевизоре?
Засветы на жидкокристаллических телевизорах – это весьма распространенная проблема, причем решить ее самостоятельно в большинстве случаев достаточно проблематично.
Если вызов квалифицированных специалистов по какой-либо причине невозможен, можно попытаться произвести нужные работы самостоятельно. Но в этом случае существует риск повреждения телевизора из-за банальной невнимательности или отсутствия опыта. Впрочем, если выбора нет, рекомендуем следовать нижеприведенным инструкциям. При таком подходе шанс на успех становится выше.
Как выявить засветы и почему при их появлении нужно производить ремонт телевизора?
Обнаружить засветы довольно просто. Достаточно выключить в помещении свет и временно закрыть окна, чтобы обеспечить максимальную темноту. Далее требуется включить черное изображение и внимательно приглядеться. Если по центру или краям экрана появились светлые точки, то это именно те засветы, о которых мы сегодня и ведем речь.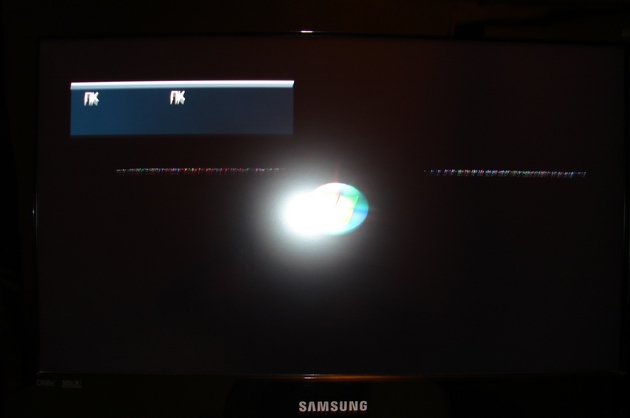
Также неисправность можно выявить путем использования демонстрационного режима. Принцип действий аналогичен. Нужно лишь хорошо приглядеться и найти места засветов. Кстати, рекомендуем это сделать сразу после покупки техники. В таком случае не придется думать, как устранить засветы на телевизоре, ведь аппарат можно будет попросту обменять на полностью работоспособную модель.
Если засветы были обнаружены слишком поздно, то лучше заказать ремонт. Иначе изображение будет неполноценным, что вызовет у владельцев техники не самые положительные эмоции. Особенно во время просмотра любимых телепередач.
Как устранить засветы на телевизоре при отклеивании рассеивателей?
При появлении крупных засветов после продолжительной эксплуатации техники рекомендуем проверить положение рассеивателей. Эти детали служат для обеспечения качественного распределения света. В случае отклеивания комплектующих, на местах их размещения и возникают засветы.
Устранить неисправность можно в несколько действий:
- поместить телевизор на большой стол экраном вниз;
- аккуратно снять заднюю крышку и отложить ее в сторону;
- бережно отсоединить и убрать шлейфы;
- снять все установленные платы вне зависимости от назначения;
- аккуратно вскрыть промежуточную крышку.

Если в открывшейся плоскости обнаружатся прозрачные элементы размером с пуговицу и пустующие места для их крепления, то предположение об отклеивании рассеивателей окажется верным. Далее останется лишь прикрепить комплектующие части на предназначенные для них места, а затем аккуратно собрать телевизор и проверить его работоспособность. Для приклеивания можно использовать суперклей. Чтобы не ошибиться в сборке, рекомендуем фотографировать этапы ремонта телевизора, после чего выполнять действия по разборке в обратном порядке.
Другие варианты ремонта телевизоров при появлении засветов
Иногда засветы появляются при «отхождении» матрицы от экрана. В этом случае нужно скорректировать ее положение. Главное – прилагать адекватные усилия, чтобы не пережать матрицу. Иначе возникнут другие неприятности.
Если интересно, как устранить засветы на телевизоре, не прибегая к внеплановому ремонту техники, то можем посоветовать снизить яркость и контрастность.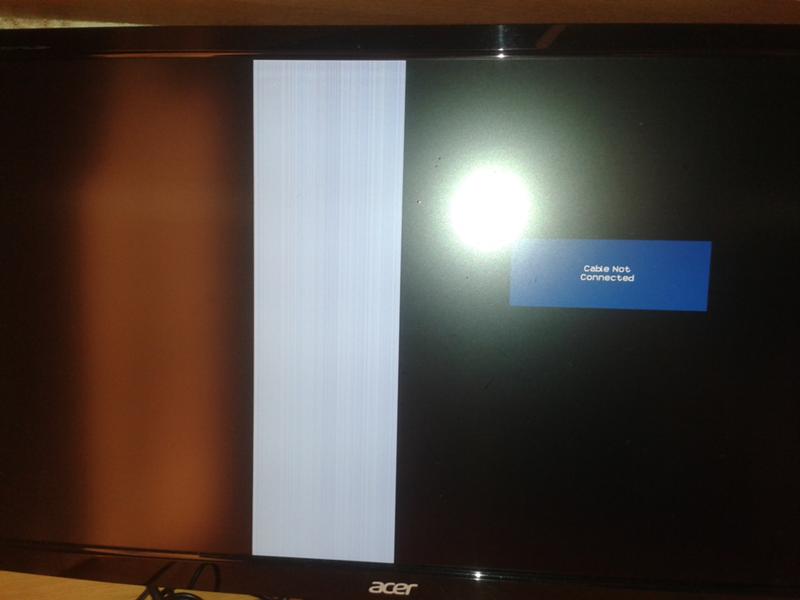 Этот шаг поможет визуально убрать слабые засветы, хотя и не избавит от проблемы в целом. Также можно попробовать прогревать устройство в течение несколько часов, хотя этот метод помогает довольно редко. Под прогревом мы имеем в виду включение и непрерывную работу телевизора.
Этот шаг поможет визуально убрать слабые засветы, хотя и не избавит от проблемы в целом. Также можно попробовать прогревать устройство в течение несколько часов, хотя этот метод помогает довольно редко. Под прогревом мы имеем в виду включение и непрерывную работу телевизора.
Целесообразен ли самостоятельный ремонт телевизоров?
В некоторых ситуациях убрать засветы можно своими руками. При наличии необходимого инструмента и хотя бы минимального опыта работы с такой техникой. Для достижения результата достаточно следовать вышеприведенным рекомендациям.
В ином случае лучше обратиться в нашу компанию и заказать ремонт телевизоров в Хабаровске. Мы выполняем работу быстро и грамотно, и сотни клиентов в этом уже убедились.
Боремся с цветными пятнами на экране телевизора — ремонтируем телевизор
Ремонт телевизоров
Например, лица героев любимого сериала в разных углах экрана приобретают фиолетовый, желтый или вовсе неприятный зеленый оттенок. И хотя подобное положение вещей выглядит по-настоящему пугающим (многие считают, что полностью вышел из строя кинескоп телевизора), но устранить такую неисправность, наверное, проще всего.
Сразу же заметим, что такого рода проблемы присущи только телевизорам и мониторам, оснащенным электронно-лучевыми трубками, которые еще называют кинескопными. Более современные плазменные или жидкокристаллические телевизоры не страдают подобной проблемой по той простой причине, что не требуют использования системы отклонения пучка электронов для создания изображения на экране.
Причин появления цветных пятен на экране кинескопного телевизора может быть несколько. Причем они могут зависеть как от внешних, так и от внутренних обстоятельств.
Появление цветных пятен на экране телевизора может быть вызвано:
- Проблемами со штатной системой размагничивания кинескопа.
 Это наиболее часто встречающаяся причина появления цветовых искажений на экране.
Это наиболее часто встречающаяся причина появления цветовых искажений на экране. - Резкие и частые циклы выключения и мгновенного включения телевизора.
- Размещения вблизи телевизора электронных систем, создающих сильное электромагнитное поле, например, звуковых колонок, радиостанций, СВЧ-печей, сотовых телефонов, фенов, миксеров и подобных им бытовых приборов.
Чтобы понять, как бороться с первой причиной неисправности, надо уяснить принципы работы штатной системы размагничивания кинескопного телевизора. Она состоит из так называемой петли размагничивания (медной спирали, намотанной вокруг кинескопа) и позистора (терморезистора, который меняет свое сопротивление в зависимости от температуры).
Опытные мастера вам скажут, что сама петля размагничивания крайне редко выходит из строя. Чаще всего проблемы создает именно позистор. Скорую смерть этого элемента вызывает привычка отключать телевизор не кнопкой на пульте дистанционного управления, а выдергиванием шнура из розетки или нажиманием кнопки питания на передней панели устройства. В этом случае через позистор кратковременно протекает ток большой величины, и этот периодический шок серьезно сокращает сроки службы термистора.
В этом случае через позистор кратковременно протекает ток большой величины, и этот периодический шок серьезно сокращает сроки службы термистора.
Опасна и другая крайность. Если вы годами не вынимаете вилку телевизора из сети, то его внутренние элементы постепенно намагничиваются от различных источников (в том числе и от магнитного поля Земли) и начинают искажать передачу цветов на экране.
Как устранить цветовые искажения на экране кинескопного телевизора
Все чрезвычайно просто и не требует вызова квалифицированного мастера с тревожным чемоданчиком. Достаточно просто отключить телевизор от сети электропитания, выждать некоторое время и затем вновь его включить. Если искажения не пропали – повторите операцию еще раз. В виде профилактики следует хотя бы раз в год отключать телевизор от электропитания механической кнопкой на его передней панели.
Если сгорел позистор
В этом случае терморезистор следует заменить исправным.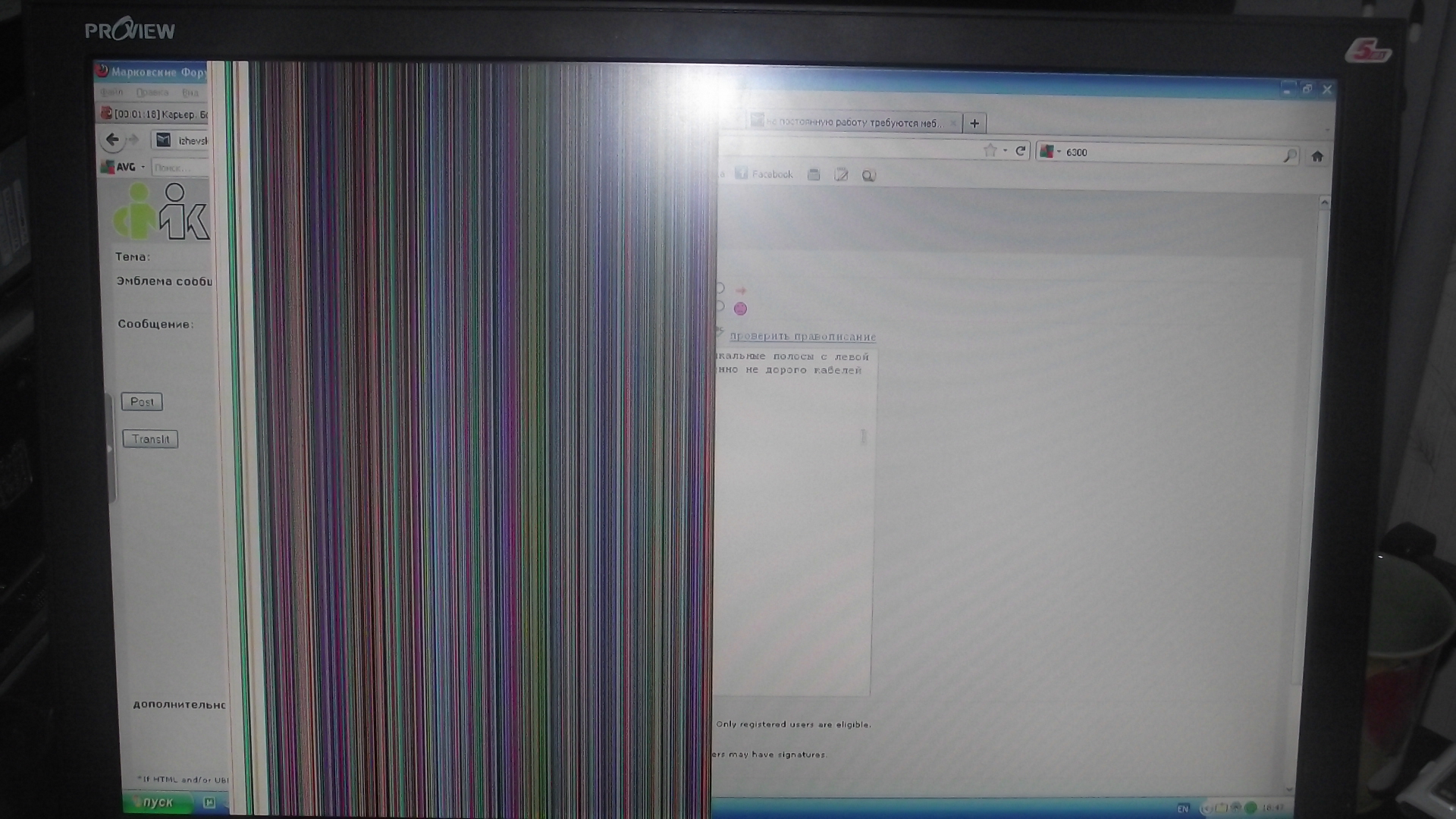 Надо разобрать телевизор и найти на шасси место подключения позистора, которое находится возле разъема для подключения петли размагничивания. Выглядит он как небольшая коробочка, бочонок или плоская таблетка с двумя выводами.
Надо разобрать телевизор и найти на шасси место подключения позистора, которое находится возле разъема для подключения петли размагничивания. Выглядит он как небольшая коробочка, бочонок или плоская таблетка с двумя выводами.
Заменять сгоревший позистор следует аналогичным элементом или другим, соответствующим ему по параметрам (сопротивлению).
Старайтесь не практиковать мгновенные отключения и включения телевизора
В этом случае позистор еще не успевает остыть и снизить свое сопротивление, поэтому слабый ток в цепи размагничивания ведет себя противоположно – намагничивает кинескоп.
И, главное, удалите подальше от телевизора все бытовые приборы, создающие вокруг себя сильное электромагнитное поле.
Где отремонтировать телевизор?
Белые пятна на экране телевизора
Наращивание оборотов производства техники часто идет рука об руку с удешевлением технологий. Матрицы жк-техники становятся несовершенными, больше уязвимыми, подверженными внешнему воздействию среды: по этим причинам нередко появляются пятна на мониторе телека. Что предпринять при обнаружении этих дефектов, нужно решать, исходя из природы и специфики обнаруженных пятен. Пятна на мониторе телека появляются изредка в результате заводского брака, механических повреждений. Такие случаи требуют замены матриц. Их во внимание брать не будем, поскольку они чаще проявляются не в виде белых кругов, а по-другому. Белыми круглыми пятнами разного диаметра могут проступать следы попадания влаги между слоями матрицы. Структура последней в разрезе выглядит как слоеный пирог:
Что предпринять при обнаружении этих дефектов, нужно решать, исходя из природы и специфики обнаруженных пятен. Пятна на мониторе телека появляются изредка в результате заводского брака, механических повреждений. Такие случаи требуют замены матриц. Их во внимание брать не будем, поскольку они чаще проявляются не в виде белых кругов, а по-другому. Белыми круглыми пятнами разного диаметра могут проступать следы попадания влаги между слоями матрицы. Структура последней в разрезе выглядит как слоеный пирог:
. Нарушения геометрии монитора приводят к проникновению пыли, влаги во внутренние межслойные матричные пространства. Инородные субстанции проявляются в виде пятен на мониторе телека при активации, в нерабочем состоянии:
серые пятна получаются от пыли, просочившейся в матрицу. Остывающий и нагревающийся прибор засасывает воздух в щели по периметру монитора, вместе с воздухом туда устремляется пыль. Беда решается продувкой слоев матрицы. Лучше доверить эту работу спецу, если допускается возможность вскрытия аппарата.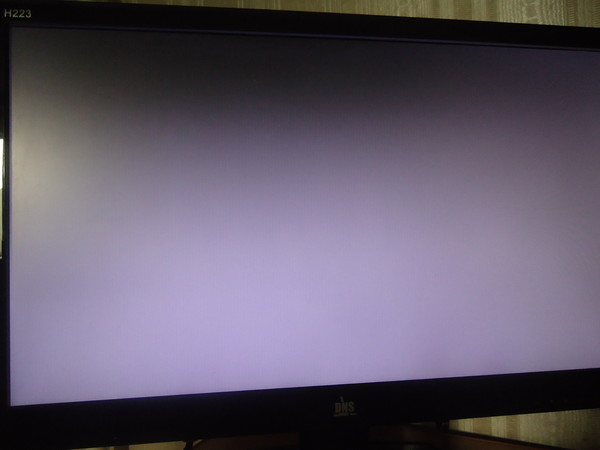 Серые пятна от пыли преимущественно поселяются по краям могут комбинироваться с белыми, но у последних другая природа;
Серые пятна от пыли преимущественно поселяются по краям могут комбинироваться с белыми, но у последних другая природа;
попадание влаги на матрицу чревато проступлением белых пятен. Изредка микрочастицы воды появляются в виде конденсата от нахождения телека в холодной влажной комнате долгое время, транспортировки его по улице в дождь, мороз. При активации прибор закипает, образуются влажные испарения, следы которых проявляются на мониторе. В идеале подобные пятна должны исчезать сами после нескольких часов работы телека. Когда они не устраняются самостоятельно, как и следы иной, попавшей во внутриматричное пространство влаги, то показана промывка монитора. Если владелец решается на самостоятельную промывку, то предпринять ее предстоит раствором дистиллированной воды с высокоочищенным спиртом или средством Лензпен. Пятна от влаги также локализуются ближе к периметру монитора. Белые разводы в других местах чаще являются результатами поломок деталей телека;
не исключено, что белесые разводы с пятнами появляются в результате некачественной уборки, размазывания на защитной панели монитора бытовых смесей, жидкостей, неудачного удаления грязи. Особенно вредны жирные консистенции: их необходимо устранять моментально же, спецсредством для ухода за мониторами. Распыленный моим малолетним ребенком из аэрозоля крем для лица, не удаленный основательно по горячим следам, так и остался в виде белого салюта на поверхности монитора. Пытаюсь постепенно растворять его остатки спецсредсвом при уборках. Альтернатива -замена внешней защиты монитора.
Особенно вредны жирные консистенции: их необходимо устранять моментально же, спецсредством для ухода за мониторами. Распыленный моим малолетним ребенком из аэрозоля крем для лица, не удаленный основательно по горячим следам, так и остался в виде белого салюта на поверхности монитора. Пытаюсь постепенно растворять его остатки спецсредсвом при уборках. Альтернатива -замена внешней защиты монитора.
Эксплуатация телека в помещениях с неидеальной чистотой, влажностью, температурными перепадами, неизбежно приведет по прошествии лет к появлениям пятен на мониторе различного спектра. Поэтому иногда нужно предпринять чистку матрицы, чтоб обновить чистоту трансляции картинки. Это допустимо предпринять самостоятельно, если телек не на гарантии, есть навыки сборки-разборки техники, а рабочее помещение увлажнено, очищено от пыли. Функционировать лучше в перчатках.
Как убрать засветы на LED-телевизоре? | Телевизоры | Блог
Как это не парадоксально звучит, но яркая область на экране LED-телевизора или монитора может всерьез и надолго омрачить настроение его обладателю.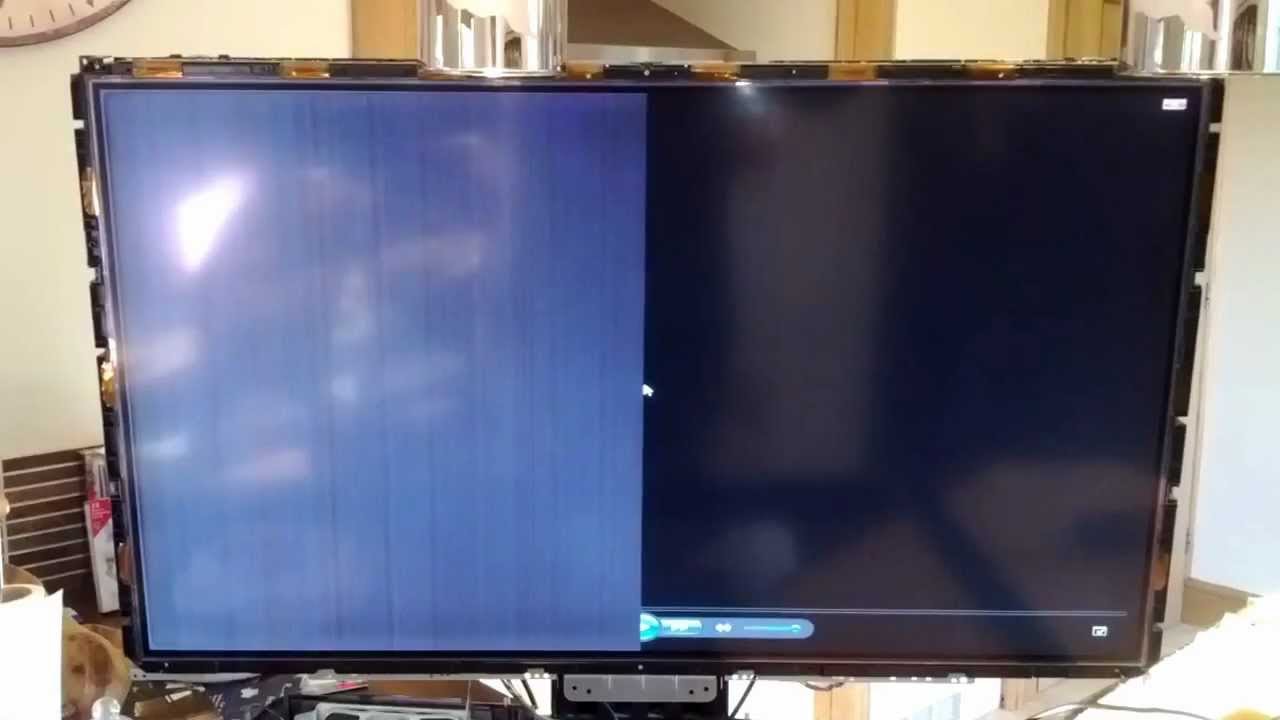 Под засветом экрана понимают яркие пятна, выделяющиеся на включенном экране во время демонстрации темных сцен.
Под засветом экрана понимают яркие пятна, выделяющиеся на включенном экране во время демонстрации темных сцен.
Данный эффект еще называют «клаудингом» (cloud (англ.) — облако), за световые пятна на экране, по форме напоминающие облака.
Природа засветов
Чтобы понять природу возникновения засветов, нужно посмотреть, как устроен LED дисплей.
Как видно из изображения, экран LED-телевизора имеет сложную многослойную структуру. Физическая деформация одного из слоев приводит к неоднородности подсветки и нежелательным засветам некоторых частей экрана. Причины, вызывающие деформацию слоев могут быть следующие:
- температурные расширения корпуса;
- удары, полученные при транспортировке или эксплуатации устройства;
- несоблюдение технологии сборки матрицы (заводской брак).
Не существует LED-телевизоров без засветов. Они в той или иной степени присутствуют на всех LED-экранах.
Это обусловлено конструкцией экрана (невозможностью обеспечения равномерной подсветки по всей его площади) и технологией производства. Причем с ростом диагонали эффект проявляется более выразительно.
Возвращаясь к схеме, видим, что существует два типа подсветки: прямая (direct LED) и боковая (EDGE LED). При прямом расположении светодиодов, как правило, засвечиваются углы экрана, а при их боковом размещении — один или оба края матрицы телевизора.
Интересна и позиция производителей. Дело в том, что они не считают засветы дефектом и только в исключительных случаях признают их гарантийным случаем. Для этого яркие пятна должны присутствовать при отображении любого, но не черного, цвета. В качестве примера можно ознакомиться с выдержкой из инструкции к телевизору одного именитого бренда: «В зависимости от угла просмотра (слева/справа/сверху/снизу) яркость и цветность панели может изменяться. Это происходит ввиду особенностей строения панели. Данные изменения не связаны с производительностью устройства и не являются неисправностью».
Данные изменения не связаны с производительностью устройства и не являются неисправностью».
Мириться с засветами или нет, каждый для себя решает сам. Но то, что это допустимо — факт! Да, яркие области на экране конечно будут отвлекать от просмотра, но, если это происходит только в очень темных сценах — это норма. Хотя, увидев засветы на своем экране, каждый приложит максимум усилий чтобы избавиться от них.
Методы борьбы с засветами
Как уже говорилось, избавиться от засветов полностью не удастся, а вот свести их к минимуму — вполне возможная и решаемая задача. Нужно воспользоваться несколькими простыми советами:
- изменение настроек яркости и контрастности экрана. Для получения более яркой и сочной картинки, большая часть мониторов и телевизоров с завода настроена на повышенные значения параметров яркости и контрастности. Уменьшение их значений может существенно снизить неприятный эффект клаудинга;
- изменение освещенности помещения.
 Как правило, засветы появляются при просмотре темных сцен в темном помещении. Включение торшера, ночника или настольной лампы может в принципе решить проблему с их появлением;
Как правило, засветы появляются при просмотре темных сцен в темном помещении. Включение торшера, ночника или настольной лампы может в принципе решить проблему с их появлением; - использование предустановленного профиля. Большинство телевизоров имеет несколько встроенных профилей яркости изображения. Один из таких — «Кино» (у разных производителей он может иметь другое название). Суть его использования такова, что при активации режима «Кино» несколько приглушается свечение верхнего и нижнего рядов светодиодных лент подсветки, тем самым создавая атмосферу кинотеатра. Что характерно, засветы так же становятся менее выраженными или пропадают вовсе;
- использование фоновой подсветки. Применение подсветки на задней плоскости телевизора, как и в случае с внешним освещением, может замаскировать нежелательные артефакты, возникающие на изображении;
- выкручивание винтов задней крышки. Порой чрезмерно притянутая крышка приводит к незначительной физической деформации матрицы, что в свою очередь провоцирует появление засветов.
 Откручивание винтов на 1-2 оборота снимает напряжение с корпуса телевизора и может существенно улучшить ситуацию с их появлением;
Откручивание винтов на 1-2 оборота снимает напряжение с корпуса телевизора и может существенно улучшить ситуацию с их появлением;
Будьте предельно внимательны — во многих моделях самостоятельное ослабление винтов крышки приводит к потере гарантии! Пользуйтесь услугами сервисных центров.
- «массаж» экрана. По статистике помогает очень редко, и то, чаще при битых пикселях, а не засветах, если виной появления артефактов действительно является коробление элементов, составляющих «пирог» экрана. Для проведения процедуры потребуется любая мягкая ткань и терпение. На экране с включенной черной заливкой, места засветов как бы разглаживаются в стороны от центра яркой области.
Проводя «массажные» процедуры нужно быть предельно аккуратным, не нужно прилагать чрезмерных усилий и давления на экран. Так можно «убить» матрицу окончательно.
Чтобы кардинально решить вопрос с клаудингом можно попытать счастья в сервисном центре с целью получения гарантийного ремонта. Но поскольку известно, что производитель не считает данное явление дефектом, то и надежда получить гарантийное обслуживание крайне туманна. Все будет зависеть от расстановки звезд на небе и доброй воли работников сервисной службы.
Но поскольку известно, что производитель не считает данное явление дефектом, то и надежда получить гарантийное обслуживание крайне туманна. Все будет зависеть от расстановки звезд на небе и доброй воли работников сервисной службы.
Значительно большие шансы быть устраненными по гарантии имею засветы, проявляющиеся на других, отличных от черного цветах. В этом случае ремонт нужно не просить, а требовать! На лицо явный заводской брак.
Когда без ремонта не обойтись
Гораздо хуже, когда вместо «облачных» засветов на экране наблюдаются яркие четкие световые точки.
Это говорит о том, что оптические рассекатели светодиодов подсветки под действием высокой температуры отклеились и отвалились. По этой причине свет не рассеивается, а бьет мощным лучом прямо через слои матрицы.
Данная проблема устраняется только в условиях мастерской, путем замены либо светодиодной сборки целиком, либо заменой испорченного источника света.
Некоторые «Кулибины» предлагают приклеить отвалившиеся рассекатели на место, но перспективы такого ремонта сомнительны. Дело в том, что позиционирование рассекателя на кристалле светодиода очень ответственная и высокоточная операция, и проделать ее «на коленке» довольно проблематично. Лучший вариант — замена.
Этот ремонт однозначно признается гарантийным, поэтому, если дефект возник в течение гарантийного срока, то он будет устранен за счет производителя.
Какие альтернативы?
Боязнь получить экземпляр с засветами, заставляет многих покупателей рассматривать альтернативные варианты и модели, полностью лишенные этого недостатка. К счастью они есть! Это телевизоры, оснащенные OLED-матрицами.
В экранах, построенных на органических диодах, модуля подсветки нет в принципе, поскольку сама матрица состоит из множества многоцветных светодиодов (по одному на каждый пиксель изображения), каждый из которых является самостоятельным источником света.
К недостаткам такого решения относятся дороговизна экрана, а, следовательно, и самого изделия и относительно короткий жизненный цикл органических светодиодов. Они деградируют и выгорают (этой напасти особенно подвержены элементы, формирующие синий цвет), что со временем приводит к потускнению изображения и безвозвратной потере пикселя.
Вывод
Бояться засветов все же не стоит. Они неприятны глазу, но совершенно безвредны устройству. А главное, в большинстве случаев «уходят» после настройки экрана под конкретные, комфортные для просмотра уровни яркости самой матрицы и освещенности помещения.
Чтобы не попадать в неприятные ситуации, особо пристальное внимание следует уделить проверкам и тестам экрана еще на этапе покупки, поскольку позже, обратить ситуацию в свою пользу будет значительно сложней.
Темные пятна на телевизоре самсунг. Темные пятна на телевизоре. Телевизоры с ЖК экраном.
Любой телевизор с жидкокристаллическим покрытием, даже самый дорогой и зарекомендовавший себя в качестве надежной техники, может оказаться неисправным или быстро испортиться при неправильной эксплуатации. В этой статье попробуем разобраться и узнать, что же нужно делать, если появилось темное пятно на экране ЖК телевизора.
Как работает схема размагничивания в кинескопных телевизорах?
Он находится в верхнем правом углу, видимый только в полностью темной комнате и во время длинных темных сцен. Помутнение появилось посреди левой стороны. При нажатии на экран оно исчезло, в некоторой степени. Это означает, что помутнение вызвано неравномерным давлением по задней подсветке. Некоторые люди сообщили, что они фиксируют свое помутнение, мягко «массируя» их экран мягкой тканью.
Он работает иногда, но не часто. Получите мягкую ткань и аккуратно втирайте в пораженные участки. Вы можете оставить его, потому что давление не должно быть достаточно высоким, чтобы повредить его. Он варьируется в зависимости от фактической единицы, поэтому вам может повезти и получить хороший.
Основные причины появления темных пятен на экране
Такие “кляксы” и точки зачастую бывают сначала чуть видными и незаметными, а затем вырастают и мешают просмотру телепередач, искажая или закрывая панель. В этом разделе мы попробуем разобраться в причинах возникновения неисправности.
Темное пятно на ЖК мониторе
Зачастую темное пятно, образовавшееся на жидкокристаллическом покрытии, говорит о неисправности самой важной детали — матрицы. В основном, это — заводские дефекты.
Этот проблесковый свет может нанести больше урона в течение определенного периода времени, или это только повлияет на черный цвет? Это видно только в темных сценах в темной комнате — не в яркой комнате. Где можно просмотреть экран при выполнении помутнений и тестирования освещения? Начните движение в сторону, и начнут появляться такие дефекты, как вспышка и помутнение.
Переместитесь в сторону, и экран выглядит почти светло-серым, с появлением некоторых вертикальных полос. Если вспышка освещения и обвязка не показывают его лицо от просмотра стороны или это нормально. Это нормально, хотя и неудачно. Все наши изображения находятся прямо в оси. Вы можете посмотреть наши видео с угла обзора, чтобы также заметить, что изображение становится белым под углом.
Итак, вот основные причины появления темных пятен на экране жк телевизора:
- Дефект появился на самом заводе. Если вы приобрели ЖК устройство и обнаружили на нем темное нарастающее пятно, то немедленно несите прибор обратно в магазин, при условии, если гарантия на него не закончилась.
- На экран случайно надавили или ударили по нему. Вероятнее всего, это ваша вина и гарантия вам не поможет, однако попытаться можно.
- Иные повреждения покрытия.
Темное пятно на плазме
Появление темного неприятного пятна на экране телевизора с плазменным экраном говорит о неполадке самих блоков, редактируемых изображение. Вероятнее всего, что эти блоки уже износились. Также в редких случаях виноваты сами производители устройства.
Они действительно были абсолютно неприемлемы, поэтому, пожалуйста, продолжайте отличную работу! Это нормально для среднего клиента, но как только вы начнете искать эти проблемы, вы найдете их повсюду. Основываясь на том, что вы сказали, похоже, что ждать три недели не поможет. Может ли сервисная технология сделать что-нибудь для этой проблемы? Это действительно не может быть исправлено техникой обслуживания. На 75-м вы не можете ожидать идеальной однородности. Если это заметно при использовании нескольких источников света с нормальным отснятым материалом, это проблема, и вы должны ее заменить.
Черные точки на кинескопной модели
На подобной модели нередко появляются такие “кляксы”, наиболее частой причиной является осыпание люминофора, нанесенный на внутреннюю сторону монитора. Он же и обеспечивает просмотр ТВ-каналов.
Данный дефект возникает в результате удара, давления, падения кинескопа или его его изношенности. Здесь может помочь только замена самого кинескопа, а стоит он немалых денег. Бывает, что поменять его невозможно. Поможет только покупка нового телевизора.
В отличие от ожога, это не то, что происходит со временем. На него влияет только физический урон. После мягкого трения ярких областей с помощью ткани из микроволокна облачность полностью исчезла. Рад слышать, что вы получили хороший результат! Помутнение — это ошибки изображения, которые возникают особенно в очень темном изображении. На снимке есть яркие пятна, как если бы кто-то осветил некоторые места изображения сзади фонариком.
Так называемое помутнение вызвано тем, что фоновое освещение многих дешевых телевизоров не было реализовано отлично. Особенно, если освещение использовалось на краю экранов, могут возникать ошибки изображения, вызванные неравномерным освещением экранов.
Важно! Помните, что если гарантия на технику еще не вышла и может еще действовать некоторое время, то срочно обратитесь в сервисный центр в своем городе и сдайте технику по гарантийному листу.
Что делать, если на ЖК телевизоре появились черные пятна?
Как и говорилось выше, в большинстве случаев появление темного пятна на экране жк телевизора является заводским браком.
Свет светоизлучающих диодов направлен на пластиковый слой, который распределяет свет, через который экран снова освещается сзади. Освещение этой технологии, конечно, не является однородным, так как интенсивность света является самой высокой на краю. Этот метод используется главным образом в целях экономии пространства.
Еще один трюк для устранения помутнения
Предостережение: Это должно использоваться с осторожностью и собственным риском и может привести к потере гарантии на производство! Здесь часто бывает достаточно половины до одного оборота, потому что винты частично завинчиваются слишком сильно от завода. После того, как телевизор снова охладится, помутнение должно быть значительно меньше.
- Ослабьте винты на задней панели телевизора.
- Затем телевизор должен быть помещен в теплую комнату около часа.
- Если помещение недостаточно нагрето, нагреватель можно включить.
Вероятнее всего, это пиксели “отмирают” от неправильной установки жидкокристаллического экрана. Обычно черные пятна такого характера со временем увеличивают свои размеры.
Вот несколько советов, что делать, если вы увидели такие “кляксы” на своем жк-экране:
- В случае, если гарантия закончилась, попробуйте написать письмо с претензиями изготовителям. В крайне редких случаях, чтобы не уронить свою репутацию, заводы могут заменить неисправную технику.
- Если вам отказали, то рекомендуем приобрести новую технику, потому что ремонт экрана зачастую превышает его цену. В общем, решать только вам.
Важно! На будущее: чтобы гарантийный срок и обязательства производителя сработали наверняка, покупайте технику зарекомендовавших себя фирм. В основном это такие марки, как SAMSUNG, LG, SONY, PHILIPS.
Часто этот эффект возникает только тогда, когда устройство достигает определенной рабочей температуры. Обычно яркие области появляются в углах экрана, которые выглядят подобно освещению прожекторами. Особенно тревожат эти эффекты, когда экран на темных сценах должен быть замечен и в затемненной комнате. Здесь эти эффекты могут ощущаться как очень тревожные. Многие владельцы устройств, которые имеют этот эффект, обеспечивают особенно хорошую вентиляцию устройства, что может фактически улучшить качество изображения.
Проще говоря, представление чрезвычайно плоской последовательности изображений, то есть относительно мягкого цветового перехода, является чем угодно, но оптимальным. Если, например, на экране видна поверхность, цвета которой проходят от темных до светлых цветов, переход от темных к ярким поверхностям должен быть как можно более жидким и однородным. В случае плохого перехода, который также упоминается как обвязка, имеется градация отдельных оттенков, которые также хорошо видны.
Появления цветного пятна
Случается и так, что ни с того, ни с сего на мониторе возникают цветные полосы и “кляксы”, ужасно искажающие изображение. Такая история происходит только со старыми кинескопными моделями.
Когда вы станете свидетелем появления таких пятен на экране телевизора, не спешите бежать в магазин, сдавать технику или писать гневные письма производителям, ведь такую проблему очень просто устранить самому.
Телевизоры с кинескопом
Такие эффекты могут часто возникать с изображениями неба или даже с облачными изображениями или изображениями лиц. Ясность так называемого эффекта группировки также зависит от физического разрешения дисплея и наибольшей площади экрана. Чем больше два, тем отчетливее проявляется неприятный эффект. Для небольших экранов эффект часто не замечается вообще.
Градуированные градуированные градиенты создаются цифровым представлением цветов. Часто такая градация также возникает в случае недостаточного разрешения цвета. Если цветовое разрешение или глубина цвета слишком малы, действительно мягкий цветовой профиль заметно разделен на полосы с одинаковой интенсивностью цвета, что заметно в эффекте полос.
Разберемся в причинах неполадок:
- Кинескоп размагнитился. Данная проблем является наиболее частой и исправить ее очень легко.
- Частое и резкое включение и выключение телевизора.
- Размещение рядом с прибором мощных устройств, образующих сильные электромагнитные волны. Например, колонки, компьютер, иногда даже телефон.
Итак, в причинах мы разобрались, но что же делать, чтобы странное свечение пропало? Вызывать на дом мастера совсем не обязательно, всю проблему можно устранить самостоятельно:
Эффект может быть уменьшен или устранен с помощью так называемого сглаживания, помощи от обработки цифрового изображения, при котором недостающие цвета компенсируются с помощью простого трюка. Один из них просто смешивает пиксели изображения из соседних цветов случайно, создавая прерывистые звуки, воспринимаемые человеческим глазом как цветовые переходы. Таким образом, два существующих цвета можно воспринимать как третий цвет, смешивая пиксели изображения для человеческого глаза.
Детали Опубликовано: вторник. Проблемы с плазменным дисплеем с логотипами-отправителями «сжигания», тенями или ореолом? Классическим «феноменом износа» часто является так называемый ожог на экранах. Эти тени появляются, когда дисплей является неподвижным изображением в течение длительного времени. Дисплей имеет так называемую «память», а также показывает в последующих фильмах это предыдущее неподвижное изображение в качестве постоянных теней в дополнение к текущей пленке.
- Самый популярный и самый простой способ — выключить прибор из розетки на несколько часов и включить заново. Если проблема не устранилась — попробуйте еще раз. Для профилактики такую процедуру можно проводить раз в месяц.
- Если способ, представленный выше, не сработал, вероятнее всего, у вас сгорел позистор. В этом случае нужно заменить терморезистор исправным, а дело это не из легких. Рекомендуем привлечь к этому дела мастера, чтобы не доламывать свою технику.
Черные точки на кинескопной модели
Более старые дисплеи были очень чувствительны к этому. В зависимости от производителя и модели быстрее. В зависимости от продолжительности предыдущего изображения неподвижного изображения. Содержимое статического изображения может сгореть и привести к огромному ухудшению качества изображения.
Обычно это результат слишком сильных светло-темных контрастов на картинке, которые в конечном итоге сжигаются. Как только изображение будет отображаться снова без черных полос, область, в которой полосы были видны раньше, была более контрастной. Область, на которой также было ранее изображено содержимое, видится, однако, исчезла. Обратите внимание на соотношение сторон: из-за конструктивных и технических причин для записи сегодня существует множество пропорций изображения. Таким образом, отношение ширины к высоте изображения.
В предложенной статье мы разобрались в причинах возникновения и способах устранения различных пятен на экранах телевизоров любой формы и размера. Помните, что даже хорошо зарекомендовавшая себя техника требует особой бдительности.
Причины . Достаточно часто встречающаяся неисправность — появление цветных пятен на экране кинескопного (ЭЛТ) телевизора.
Сегодняшние устройства обычно имеют соотношение сторон изображения 16: если содержание изображения имеет другое соотношение сторон, чем устройство воспроизведения, черная полоса обычно отображается на ненужной области отображения. В таких случаях ранее отображаемый логотип передатчика теперь отображается в дополнительных цветах после того, как канал был изменен. На рисунке 2 красная плазма тяжелее красной и зеленой плазмы. Если теперь будет отображаться белый цвет, красная плазма в этих областях уже потребляется.
Таким образом, равная доля всех трех основных цветов больше не доступна. Это приводит к изменению цвета вместо белого изображения. Рассмотренные выше типичные явления старения в плазме и эффекты ожога значительно увеличиваются за счет неверно заданных параметров изображения дисплея. По этой причине плазменный дисплей должен быть правильно настроен в течение первых часов работы — особенно слишком высокий контраст следует избегать — кроме того, такое же статическое изображение не должно отображаться слишком долго.
Практически всегда, эта неисправность означает намагничивание экрана.
Иногда неисправность можно своими силами устранить, а иногда это поломка телевизора и необходимо вызывать мастера по ремонту.
Важно. Если цветные пятна появились после падения телевизора или удара по нему, то, скорее всего, вышел из строя кинескоп. В настоящее время чинить это либо невозможно либо крайне дорого.
Обязательно установите правильное соотношение сторон вашего устройства. Некоторые устройства также поддерживают режим, в котором известные черные полосы могут быть заменены светло-серыми или цветными полосками. Эта функция также помогает избежать опасности ожога и должна быть активирована в течение первых 100 часов работы плазмы. Описанные эффекты более выражены в плазменных дисплеях. Здесь особенно затронуты более старые модели. Однако из-за непрерывного развития используемой плазмы опасность горения может быть успешно уменьшена.
Здесь вы упоминаетесь как склеивание изображений и имеют другой технический фон. Степень, в которой эти эффекты происходят в вашем конкретном случае, зависит от самого устройства, возраста устройства, внутренней технологии и многих других факторов. Видеопоследовательность начинается с белого изображения, за которым следуют желтое изображение и два разных шумовых изображения. Первое шумовое изображение гарантирует, что ток подается на отдельные пиксели дисплея с нерегулярными интервалами или что ток отсутствует.
— Так как техника, стоящая рядом с телевизором, может создавать наводки, то сначала стоит ее передвинуть на «безопасное» расстояние.
— Редко случается так, что телевизор поставлен в неудачное место. Все-таки можно попробовать переместить аппарат в другое место и там его включить. Это может помочь убрать пятна с экрана.
— Самый надежный способ убрать намагничивание экрана — выключить телевизор сетевой кнопкой, выдернуть вилку из розетки и подождать 20 минут. Потом включить телевизор снова. Желательно повторить это действие дважды.
Возможные причины неисправности
Это вызывает повторную активацию пикселей. Помимо изменения тока и отсутствия тока отображается медленный шум, который является серой шкалой. Через пять минут снова отображается белое изображение. Через тридцать секунд снова отображается желтое изображение, также в течение тридцати секунд.
Наши тесты показали, что часто необходимо последовательно воспроизводить шумовую последовательность до 10 раз подряд. Проверьте улучшение после каждого прохода, используя белые и желтые изображения. Наш совет! — Отображается как дисплей. Если вы используете дисплей в качестве панели дисплея, обратите внимание на некоторые важные моменты.
Если двойное «выключение-отдых-включение» не помогло, вероятнее всего, в телевизоре неисправна схема размагничивания. Поломка достаточно простая и чинится мастером практически всегда.
Использование высушенных пятен плазмы для количественного определения йоталамата в клинических исследованиях
Clin J Am Soc Nephrol. 2013 7 июня; 8 (6): 909–914.
, * , † и *Эндрю С. Хаган
* Школа медицины Университета Индианы и Медицинский центр Управления ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
Дэвид Р. Джонс
† Отдел клинической фармакологии, Медицинский факультет Университета Индианы, Индианаполис, Индиана
Раджив Агарвал
* Медицинский факультет Университета Индианы и Ричард Л.Медицинский центр администрации ветеранов Рудебуша, Индианаполис, Индиана; и
* Медицинский факультет Университета Индианы и Медицинский центр администрации ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
† Отдел клинической фармакологии, Медицинский факультет, Школа медицины Университета Индианы, Индианаполис, Индиана
Автор, отвечающий за переписку. Для корреспонденции: Доктор Раджив Агарвал, Университет Индианы и Медицинский центр Управления ветеранов, 1481 West 10th Street, Индианаполис, IN 46202.Электронная почта: ude.iupui@lawragarПолучено 12 октября 2012 г .; Принято 11 января 2013 г.
Авторские права © Американское общество нефрологов, 2013 г. Эта статья цитируется в других статьях в PMC.Резюме
Предпосылки и цели
Хотя зазоры иоталамата широко использовались для измерения СКФ, необходимость транспортировки образцов плазмы в охлажденных условиях исключает его использование в ситуациях нехватки ресурсов. Пятна крови или плазмы, высохшие на фильтровальной бумаге, могут стать решением.
Дизайн, условия, участники и измерения
Используя проверенную методику ВЭЖХ, измеряли иоталамат в сухих пятнах крови с различными гематокритами. СКФ измеряли в течение 5 часов у 10 пациентов с ХБП с использованием пятен высушенной плазмы и стандартных методов.
Результаты
Снижение гематокрита привело к увеличению площади распространения крови и снижению извлечения йоталамата из засохших пятен крови. Однако соотношение между концентрациями иоталамата в пятнах высушенной плазмы и плазмы показало наклон регрессии, равный 0.95 (95% доверительный интервал = 0,92–0,98, P <0,001). График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 μ г / мл и пределы согласия от -38 до +30 μ г / мл. Взаимосвязь между СКФ при использовании пятен высушенной плазмы и методами плазмы также показала отличную взаимосвязь (наклон 0,95, 95% доверительный интервал = 0,82–1,17). График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин. Точность обычно составляла от 5% до 10%, а точность — в пределах 5%.
Выводы
Хотя сухие пятна крови не подходят для исследований среди пациентов с очень низким гематокритом, пятна высушенной плазмы корректируют это ограничение, и это небольшое пилотное исследование показывает, что это достаточно надежный метод количественного определения йоталамата и последующего определения СКФ. .
Введение
СКФ необходимо определить для точной оценки функции почек и стадии ХБП. Золотым стандартом для измерения СКФ считается клиренс инулина, природного полисахарида, который не секретируется и не реабсорбируется почечными канальцами (1,2).Однако инулин дорог и его не хватает; поэтому были разработаны альтернативные методы измерения СКФ (3). Одним из таких методов является измерение клиренса иоталамата (IOT) после болюсной инъекции, что обеспечивает точное и точное определение СКФ (4). Определение клиренса ВГД с помощью традиционного анализа плазмы имеет ограничения, включая необходимость венозной канюляции для отбора проб больших объемов крови, а также неотъемлемые затраты на хранение и транспортировку проб.
Возможным решением вышеуказанных ограничений является использование сухих пятен крови (DBS) на фильтровальной бумаге. Фильтровальная бумага использовалась для сбора, хранения и анализа крови человека с момента ее принятия доктором Робертом Гатри для обнаружения фенилаланина при диагностике фенилкетонурии у новорожденных в 1960-х годах (5). Последние достижения позволяют шире использовать DBS в клинических испытаниях для анализа ряда небольших молекул лекарств (6–10). К преимуществам DBS по сравнению с анализом плазмы можно отнести следующие.( 1 ) Меньший объем крови (<100 µ л) на образец делает матрицу применимой к педиатрическим или тяжелобольным пациентам, где больший объем крови может быть нежелательным. ( 2 ) Для отбора проб можно использовать уколы из пальца. Этот метод сбора крови легче выполнять персоналу, и пациенты предпочитают его, а не венозную канюлю. Менее инвазивный забор крови может улучшить набор и удержание участников исследования. ( 3 ) DBS можно транспортировать и хранить при температуре окружающей среды, что устраняет необходимость в дорогостоящих морозильных камерах и транспортировке с сухим льдом.( 4 ) Антимикробная природа бумаги не требует мер по обеспечению биологической опасности при транспортировке (11). У DBS есть свои ограничения, в первую очередь неопределенность влияния уровня гематокрита крови на результаты тестов.
Гематокрит может изменять вязкость крови и влиять на результаты количественного определения с использованием DBS (12). Например, образец крови с высоким гематокритом, вероятно, более вязкий по сравнению с образцом с более низким уровнем гематокрита и может меньше растекаться на фильтровальной бумаге.В свою очередь, это может изменить количество образца, полученного при отборе пуансона фиксированного диаметра из DBS. Решением этой досадной проблемы может быть использование пятна высушенной плазмы (DPS), вязкость которого не зависит от уровня гематокрита. Соответственно, мы предположили, что ( 1 ) гематокрит будет влиять на степень растекания на фильтровальной бумаге и, следовательно, концентрацию IOT в плазме, ( 2 ) DPS будет корректировать эффект гематокрита, и ( 3 ) DPS обеспечит приемлемую корреляцию с эталонным методом определения СКФ.
Метод DPS был бы наиболее полезен в группах населения, где оценка СКФ на основе уравнений сывороточного креатинина не была адекватной, например, у пациентов с циррозом или саркопенией печени или у пациентов с крайним возрастом. Уравнения креатинина сыворотки не являются оптимальными при сравнении людей из разных популяций или среди пациентов с минимальным нарушением функции почек (13). DPS может подойти в вышеупомянутых ситуациях.
Целью данного исследования является описание разработки и валидации метода количественной оценки ВГД в плазме человека, приготовленной в виде DPS, детектируемого с помощью ВЭЖХ-тандемного ультрафиолета (УФ).Метод был подтвержден путем сравнения измеренной СКФ с использованием традиционного анализа плазмы.
Материалы и методы
Химикаты, реагенты, оборудование, приборы для ВЭЖХ-УФ и метод
Химикаты, реагенты, оборудование и приборы для ВЭЖХ-УФ были созданы с использованием ранее опубликованного метода, используемого для анализа стандартов и образцов плазмы участников (14 ). Дополнительные химикаты, реагенты и оборудование следующие. Упакованные эритроциты человека и свежезамороженная плазма поставлялись через Центр Ричарда Л.Банк крови Медицинского центра Управления ветеранов Рудебуша (Индианаполис, Индиана). Карты FTA DMPK-A, FTA DMPK-B, FTA DMPK-C, Harris 6-мм Uni-Core и 903 Specimen Protein Saver Card были получены через GE Healthcare (Бакингемшир, Великобритания).
DBS Sample Preparation
Первоначальные эксперименты показали, что результаты хроматографии схожи со всеми фильтрами. Карточки сохранения протеина 903 были самыми дешевыми; поэтому все эксперименты проводились с использованием этой бумаги.Используя регулируемую микропипетку, 15 мкл мкл крови были нанесены на центр 903 карты сохранения белка для образцов. Карточкам давали высохнуть на открытом воздухе в течение 2 часов в вертикальном положении. Карты затем переносили в эксикатор, содержащий рыхлый сухой осушитель, для дополнительной сушки в течение ночи. Диск диаметром 6 мм пробивали из пятна в микроцентрифужную пробирку объемом 2 мл; 100 мкл мкл подвижной фазы (85% 50 мМ натрий-фосфатного буфера, 10% метанола, 5% ацетонитрила).Образцы встряхивали в течение 60 минут, а затем центрифугировали в течение 2 минут при 14000 об / мин. Полученный супернатант переносили в чистую микроцентрифужную пробирку объемом 1,5 мл и центрифугировали в течение 6 минут при 14000 об / мин. Затем супернатант переносили в чистый сосуд, закрывали крышкой и анализировали с помощью ВЭЖХ-УФ.
DPS Подготовка образца
С помощью регулируемой микропипетки 15 мкл мкл плазмы были нанесены на центр карты сохранения белка для образцов 903. Остальная часть подготовки DPS соответствует контуру образцов DBS.
Влияние эффекта гематокрита на DBS
Образцы крови с определенным уровнем гематокрита (21,2% или 33,5%) получали разбавлением эритроцитов свежезамороженной плазмой. Для каждого уровня гематокрита были сделаны шесть пятен DBS, были получены цифровые изображения DBS и площадь пятна крови была определена с использованием формулы вычисления площади с использованием Photoshop Creative Suite 5 (Adobe Systems, Сан-Хосе, Калифорния). Полные стандартные кривые были построены для каждой концентрации гематокрита путем добавления IOT и нанесены пятнами.
DPS Коррекция эффекта гематокрита у отдельных лиц
Были обнаружены образцы плазмы от 10 субъектов с диапазоном гематокрита (27,9–44,8), взятые в 12 точках в течение 5 часов после болюсной инъекции ВГД. Концентрации сравнивали с образцами плазмы, не нанесенными на фильтровальную бумагу и приготовленными параллельно. График Бланда – Альтмана (разница средних) использовался для анализа соответствия между DPS и традиционными плазменными методами.
Популяция исследования
Популяция исследования состояла из 10 участников в возрасте от 41 до 82 лет со средним значением (± стандартное отклонение) 65.2 ± 13,4 года. Шесть участников были мужчинами. Пять участников были белыми, а пять — черными. Девять пациентов страдали анемией легкой степени, со средним уровнем гемоглобина 11,46 ± 1,32 г / дл и средним гематокритом 34,04 ± 4,19%. Средняя расчетная СКФ составляла 33,4 ± 10,1 мл / мин на 1,73 м 2 (диапазон = 18–55,9 мл / мин на 1,73 м 2 ). Этиология ХБП заключалась в гипертоническом нефросклерозе у четырех участников, сахарном диабете у четырех участников и обструктивной уропатии у двух участников.
Сравнение DPS с плазмой при оценке СКФ.
Были построены фармакокинетические параметры между параллельными DPS и традиционными наборами образцов участников из плазмы ( n = 10).СКФ оценивали для каждого метода и сравнивали с использованием программного обеспечения WinNonlin (Сент-Луис, Миссури) и двухфармакокинетической модели, как описано ранее (15). Опять же, график Бланда-Альтмана использовался для проверки соответствия между двумя методами.
Валидация метода: меж- и внутридневная изменчивость
Точность и прецизионность метода определяли путем анализа повторений полных стандартных кривых в течение одного и того же цикла и в шести отдельных случаях в течение 60 дней. Определены точность и прецизионность.Прецизионность определялась путем расчета коэффициента вариации (CV) в пределах 1 дня (внутридневная точность) и между днями (внутридневная точность). Точность определялась путем вычисления процента ошибки (наблюдаемое – прогнозируемое) × 100 / прогнозируемое.
Стандарт плазмы, приготовленный до концентрации, равной половине от самой нижней точки кривой (25 µ г / мл), наносили на 903 карточки ( n = 14). Были рассчитаны площади для определения обнаруживаемости и точности. Протокол был одобрен Институциональным наблюдательным советом Университета Индианы по защите людей и Комитетом по исследованиям и развитию по делам ветеранов, и каждый субъект подписал письменное информированное согласие.
Результаты
Влияние эффекта гематокрита на DBS
Площадь пятен цельной крови с гематокритом 33,5% была примерно на 10% меньше, чем пятна с гематокритом 22,2% (, вставка). Неудивительно, что стандартная кривая, полученная с гематокритом крови 22,2% и 33,5%, давала различные ответы с пиковой площадью пика ВГД (). Как и ожидалось, по сравнению с образцами с 22,2% средние наклоны площади IOT по сравнению с концентрацией в образцах с гематокритом 33,5% были на 37% больше.
Сравнение стандартных кривых концентраций иоталамата с площадью пика, измеренной с помощью ВЭЖХ, показывает, что более низкий гематокрит вызывает более низкое извлечение иоталамата. На вставке показано, что площадь, занимаемая пятном равного объема крови, больше при более низком гематокрите.
DPS Коррекция гематокритного эффекта у людей
Отношение между концентрацией IOT участников в DPS и плазме было отличным (). Регрессия концентрации, оцененной двумя методами, показала наклон 0,95, который значительно отличался от 1. Таким образом, по сравнению со стандартным методом отбора проб IOT, метод DPS дал среднюю концентрацию в парных точках выборки, которая была на 5% ниже по сравнению с плазма.График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл (, вставка). Поскольку распределение различий не было нормально распределенным, что привело к появлению мегафонного или V-образного графика, мы вычислили логарифмически преобразованные различия. Смещение составило 1,7% (95% доверительный интервал = -22,3%, 21,0%).
Показана взаимосвязь между концентрацией йоталамата у участников, полученной стандартным методом, и пятнами высушенной плазмы. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,92–0,98. На вставке показан график Бланда – Альтмана парных точек выборки ( n = 116), который показывает смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл.
Сравнение DPS с плазмой при оценке СКФ
Отношение между расчетной СКФ в DPS и плазменных методах было отличным (). Хотя регрессия СКФ, оцененная двумя методами, показала наклон 0.95, он не отличался значительно от 1, потому что 95% доверительный интервал наклона включал 1. График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от -6 до +10 мл. / мин (, Врезка).
Показана взаимосвязь между оценкой СКФ с использованием пятна высушенной плазмы и стандартным методом. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,82–1,07. На вставке показан график Бланда – Альтмана для парных точек выборки ( n = 10), который показывает смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин.
Парные концентрации ионов плазмы и DPS в зависимости от времени для каждого из 10 субъектов показаны в. Большинство измерений мало различались между методами, показанными количественно в.
Соответствие между методами показано в виде динамики кривых распада иоталамата за 300 минут для каждого из 10 субъектов. Каждая панель представляет один предмет; треугольники обозначают стандартный метод, а кружки обозначают метод DPS.
Точность и прецизионность теста – повторного тестирования
Результаты тестирования – повторного тестирования показаны на рис.Точность обычно составляла от 5% до 10%, а точность — в пределах 5%. Статистически значимые, но небольшие неточности наблюдались для самых высоких и самых низких концентраций IOT. Среднее значение CV и ошибка для каждой точки стандартной кривой находились в пределах принятых критериев валидации анализа (<15%) (15). Дневные наклоны имели CV 4,7%, тогда как дневные CV наклонов составляли 3,8%. Мы измерили площадь пика с номинальной концентрацией 25 µ мкг / мл IOT в плазме. В каждом случае четко распознавался пик IOT, и площадь пика имела CV 9.7%.
Таблица 1.
Точность и прецизионность повторных испытаний
| Номинальная концентрация йоталамата ( µ г / мл) | Средняя концентрация ( µ г / мл) | SD | Эффективная точность (% -ный коэффициент) отклонения) | Точность (% ошибки, 95% доверительный интервал) | ||||
|---|---|---|---|---|---|---|---|---|
| Проведение дневного диагностического теста | ||||||||
| 50 | 48 6 | 90.32,4 (-11,3, 1,3) | ||||||
| 100 | 96 | 7 | 6,9 | 2,7 (-10,9, 3) | ||||
| 200 | 5,3194 | 26 | (−16,5, 10,7)||||||
| 300 | 300 | 20 | 6,5 | 2,7 (−6,8, 7) | ||||
| 500 | 511 | 16 | 3,2 | 9024,1 5.7)|||||
| 1000 | 1052 | 53 | 5 | 2.2 (-0,3, 10,8) | ||||
| Производительность дневного диагностического теста | ||||||||
| 50 | 55 | 4 | 7,9 | 100 9023 | 103 | 8 | 7,9 | 3,4 (−5,2, 12) |
| 200 | 212 | 18 | 8,3 | 3,6 (−3,3, 15,2) | 27 | 8.8 | 3,7 (−5,9, 13,3) | |
| 500 | 511 | 21 | 4 | 1,7 (−2,1, 6,6) | ||||
| 1000 | 1067 | 43 4 9022 (2.2, 11.2) |
Мы можем быть осторожно уверены, что IOT стабильно в фильтровальной бумаге в течение 60 дней. Мы подготовили образцы DPS в первый день и повторно использовали эти стандарты для измерения межсуточной изменчивости. Наибольшее время среди измерений IOT составило 60 дней.В это время было хорошее согласие в измерении тест-повторный тест, как показано на.
Обсуждение
Результаты наших экспериментов показывают разработку и валидацию простого быстрого анализа для количественной оценки концентраций ВГД и последующего определения СКФ в образцах DPS человека с помощью ВЭЖХ-УФ, показывая приемлемую корреляцию с традиционной обработкой плазмы. Некоторые выводы заслуживают внимания и будут обсуждаться.
Изменение гематокрита между образцами соответствует наблюдаемому изменению размера пятна согласованных объемов (9.8%). Большее распространение образцов с более низким гематокритом вызывает большее распределение ВГД на фильтровальной бумаге. Как и ожидалось, пробойник фиксированного диаметра, взятый из пятен с разным уровнем гематокрита, эффективно отбирает разные объемы крови. Таким образом, из образцов с более низким гематокритом извлекается более низкая концентрация ВГД. Изменение площади пика IOT не соответствует линейно увеличению площади пятна и не может быть эффективно компенсировано в этом анализе. Это открытие является особенно важным ограничением DBS при использовании у людей с ХБП, у которых может быть аномально низкий уровень гематокрита.Хотя измерение клиренса ВГД для определения СКФ у участников с тяжелой анемией не является обычным делом, по сравнению с методом DBS, использование метода DPS может дать более надежные результаты, особенно среди лиц с тяжелой анемией.
Использование плазмы на фильтровальной бумаге устраняет вариабельность уровней гематокрита за счет более сложной подготовки проб. Использование DPS требует наличия центрифуги и пробирок для сбора крови для фракционирования цельной крови. Тем не менее, подготовка образцов по-прежнему проще, чем традиционный метод плазмы, поскольку устраняется необходимость в больших объемах с помощью венозной канюли, хранения и ограничений транспортировки образцов.DPS предоставил подходящую альтернативу плазме для количественного определения концентрации ВГД в плазме у участников с ХЗП.
Важным выводом нашего исследования было то, что, несмотря на большие различия в уровнях гематокрита среди участников, не наблюдалось значительных различий в расчетной концентрации ВГД между методами. Смещение в методе парной пробы плазмы по сравнению с методом DPS было низким, а точность для каждой парной временной точки между методами находилась в пределах 15%. Кроме того, рассчитанная СКФ у участников обеспечивает точность в пределах 15% между методами, показывая, что DPS является подходящей альтернативой плазме для оценки СКФ для оценки почечной гемодинамики и стадии ХБП.
Все процессы внутридневной и междневной валидации обеспечили точность и прецизионность в рамках принятых критериев валидации анализа и показали, что аналит стабилен в фильтровальной бумаге до 60 дней (16). Площади пиков образцов в плазме всего 25 µ г / мл можно было легко визуализировать, а надежность суточного теста-повторного тестирования для оценки площади пика составляла <10%.
Ограничения этого пилотного исследования включают небольшой размер выборки участников ( n = 10). Дополнительные эксперименты с участием более крупных образцов улучшили бы статистическую мощность тестов.Дополнительным ограничением является то, что используемый в настоящее время более низкий уровень гематокрита 22,2% при сравнении распространения мажущих кровянистых выделений находится на нижних границах того, что можно увидеть клинически. У стабильных пациентов с ХБП меньше шансов встретить широкий диапазон уровней гематокрита. Дополнительные эксперименты, включающие более узкие диапазоны уровней гематокрита, могут быть желательными для характеристики влияния гематокрита на восстановление DBS.
Будущие эксперименты, проведенные для преодоления эффекта гематокрита, могут расширить область применения DBS для включения участников с различным уровнем гематокрита.Обнаружение известного объема и взятие всего пятна для анализа свело бы на нет эффект распределения образца и обеспечило бы анализ фиксированного объема крови.
Таким образом, мы показываем, что DBS не подходят для исследований, в которых участвуют люди с аномальным уровнем гематокрита. Тем не менее, DPS корректируют это ограничение, и они являются надежным методом для количественной оценки IOT и последующего определения GFR. Текущий метод показывает приемлемую точность, прецизионность и надежность в соответствии с общепринятыми критериями валидации.Матрица DPS может позволить осуществлять выборку из групп населения, которые ранее были ограничены (педиатрические или тяжелобольные или пациенты, проживающие в отдаленных районах) из-за необходимости меньшего объема крови, а также обеспечивать более простые и экономичные средства хранения и транспортировки образцов. .
Раскрытие информации
R.A. входит в состав руководящих комитетов исследований, финансируемых Roche, Amgen, Celgene и Reata, а также в бюро спикеров Merck и Abbott, а также является консультантом Daichii Sankyo, Inc., Takeda Pharma и Sigma Tau.
Благодарность
Исследование было частично поддержано Национальными институтами здравоохранения (грант 5 U01-DK071633-05).
Сноски
Публикуется в Интернете перед печатью. Дата публикации доступна на сайте www.cjasn.org.
Ссылки
2. Флорийн К.В., Барендрегт Дж. Н., Лентес Э. Г., ван Дам В., Проджосуджади В., ван Заас Дж. Л., ван Эс Л. А., Чанг П. С. Измерение скорости клубочковой фильтрации с помощью однократной инъекции инулина. Почка Int 46: 252–259, 1994 [PubMed] [Google Scholar] 3.Agarwal R: Амбулаторное измерение СКФ с холодным йоталаматом у взрослых с хроническим заболеванием почек. Am J Kidney Dis 41: 752–759, 2003 [PubMed] [Google Scholar] 4. Доулинг Т.С., Фрай Р.Ф., Фрейли Д.С., Мацке Г.Р.: Сравнение методов очистки от йоталамата для измерения СКФ. Фармакотерапия 19: 943–950, 1999 [PubMed] [Google Scholar] 5. Гатри Р., Сьюзи А.: Простой метод фенилаланина для обнаружения фенилкетонурии в больших популяциях новорожденных. Педиатрия 32: 338–343, 1963 [PubMed] [Google Scholar] 6.Мей Дж. В., Александр Дж. Р., Адам Б. В., Хэннон В. Х .: Использование фильтровальной бумаги для сбора и анализа образцов цельной крови человека. J Nutr 131: 1631S – 1636S, 2001 [PubMed] [Google Scholar] 7. Li W, Tse FL: отбор проб высушенной крови в сочетании с ЖХ-МС / МС для количественного анализа малых молекул. Биомедицинский хроматограф 24: 49–65, 2010 [PubMed] [Google Scholar] 8. Нельсон К. Б., Дамброзия Дж. М., Гретер Дж. К., Филлипс Т. М.: Неонатальные цитокины и факторы свертывания крови у детей с церебральным параличом. Энн Нейрол 44: 665–675, 1998 [PubMed] [Google Scholar] 9.Патчен Л.С., Маунт Д.Л., Шварц И.К., Черчилль Ф.К .: Анализ образцов крови, абсорбированных фильтровальной бумагой, на содержание хлорохина и его основного метаболита с использованием высокоэффективной жидкостной хроматографии с флуоресцентным детектированием. J Хроматограф A 278: 81–89, 1983 [PubMed] [Google Scholar] 10. Спунер Н., Лад Р., Барфилд М.: Высушенные пятна крови как метод сбора образцов для определения фармакокинетики в клинических исследованиях: Соображения по валидации количественного биоаналитического метода.Анальный хим 81: 1557–1563, 2009 [PubMed] [Google Scholar] 12. Patel P, Mulla H, Tanna S, Pandya H: Содействие фармакокинетическим исследованиям у детей: новое использование сухих пятен крови. Арка Дис Дитя 95: 484–487, 2010 [PubMed] [Google Scholar] 13. Эрли А., Мискулин Д., Лэмб Э. Дж., Леви А. С., Улиг К.: Расчетные уравнения для скорости клубочковой фильтрации в эпоху стандартизации креатинина: систематический обзор. Энн Интерн Мед 156: 785–795, 2012 [PubMed] [Google Scholar] 14. Агарвал Р., Васавада Н., Чейз С.Д.: Жидкостная хроматография иоталамата в биологических образцах.J Chromatogr B Analyt Technol Biomed Life Sci 785: 345–352, 2003 [PubMed] [Google Scholar] 15. Agarwal R, Bills JE, Yigazu PM, Abraham T, Gizaw AB, Light RP, Bekele DM, Tegegne GG: Оценка клиренса йоталамата из плазмы: Продолжительность исследования влияет на качество СКФ. Clin J Am Soc Nephrol 4: 77–85, 2009 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Shah VP, Midha KK, Findlay JW, Hill HM, Hulse JD, McGilveray IJ, McKay G, Miller KJ, Patnaik RN, Powell ML, Tonelli A, Viswanathan CT, Yacobi A: валидация биоаналитического метода — пересмотр с десятилетним прогрессом .Pharm Res 17: 1551–1557, 2000 [PubMed] [Google Scholar]Использование высушенных плазменных пятен для количественного определения йоталамата в клинических исследованиях
Clin J Am Soc Nephrol. 2013 7 июня; 8 (6): 909–914.
, * , † и *Эндрю С. Хаган
* Школа медицины Университета Индианы и Медицинский центр Управления ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
Дэвид Р. Джонс
† Отдел клинической фармакологии, Медицинский факультет Университета Индианы, Индианаполис, Индиана
Раджив Агарвал
* Медицинский факультет Университета Индианы и Ричард Л.Медицинский центр администрации ветеранов Рудебуша, Индианаполис, Индиана; и
* Медицинский факультет Университета Индианы и Медицинский центр администрации ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
† Отдел клинической фармакологии, Медицинский факультет, Школа медицины Университета Индианы, Индианаполис, Индиана
Автор, отвечающий за переписку. Для корреспонденции: Доктор Раджив Агарвал, Университет Индианы и Медицинский центр Управления ветеранов, 1481 West 10th Street, Индианаполис, IN 46202.Электронная почта: ude.iupui@lawragarПолучено 12 октября 2012 г .; Принято 11 января 2013 г.
Авторские права © Американское общество нефрологов, 2013 г. Эта статья цитируется в других статьях в PMC.Резюме
Предпосылки и цели
Хотя зазоры иоталамата широко использовались для измерения СКФ, необходимость транспортировки образцов плазмы в охлажденных условиях исключает его использование в ситуациях нехватки ресурсов. Пятна крови или плазмы, высохшие на фильтровальной бумаге, могут стать решением.
Дизайн, условия, участники и измерения
Используя проверенную методику ВЭЖХ, измеряли иоталамат в сухих пятнах крови с различными гематокритами. СКФ измеряли в течение 5 часов у 10 пациентов с ХБП с использованием пятен высушенной плазмы и стандартных методов.
Результаты
Снижение гематокрита привело к увеличению площади распространения крови и снижению извлечения йоталамата из засохших пятен крови. Однако соотношение между концентрациями иоталамата в пятнах высушенной плазмы и плазмы показало наклон регрессии, равный 0.95 (95% доверительный интервал = 0,92–0,98, P <0,001). График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 μ г / мл и пределы согласия от -38 до +30 μ г / мл. Взаимосвязь между СКФ при использовании пятен высушенной плазмы и методами плазмы также показала отличную взаимосвязь (наклон 0,95, 95% доверительный интервал = 0,82–1,17). График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин. Точность обычно составляла от 5% до 10%, а точность — в пределах 5%.
Выводы
Хотя сухие пятна крови не подходят для исследований среди пациентов с очень низким гематокритом, пятна высушенной плазмы корректируют это ограничение, и это небольшое пилотное исследование показывает, что это достаточно надежный метод количественного определения йоталамата и последующего определения СКФ. .
Введение
СКФ необходимо определить для точной оценки функции почек и стадии ХБП. Золотым стандартом для измерения СКФ считается клиренс инулина, природного полисахарида, который не секретируется и не реабсорбируется почечными канальцами (1,2).Однако инулин дорог и его не хватает; поэтому были разработаны альтернативные методы измерения СКФ (3). Одним из таких методов является измерение клиренса иоталамата (IOT) после болюсной инъекции, что обеспечивает точное и точное определение СКФ (4). Определение клиренса ВГД с помощью традиционного анализа плазмы имеет ограничения, включая необходимость венозной канюляции для отбора проб больших объемов крови, а также неотъемлемые затраты на хранение и транспортировку проб.
Возможным решением вышеуказанных ограничений является использование сухих пятен крови (DBS) на фильтровальной бумаге. Фильтровальная бумага использовалась для сбора, хранения и анализа крови человека с момента ее принятия доктором Робертом Гатри для обнаружения фенилаланина при диагностике фенилкетонурии у новорожденных в 1960-х годах (5). Последние достижения позволяют шире использовать DBS в клинических испытаниях для анализа ряда небольших молекул лекарств (6–10). К преимуществам DBS по сравнению с анализом плазмы можно отнести следующие.( 1 ) Меньший объем крови (<100 µ л) на образец делает матрицу применимой к педиатрическим или тяжелобольным пациентам, где больший объем крови может быть нежелательным. ( 2 ) Для отбора проб можно использовать уколы из пальца. Этот метод сбора крови легче выполнять персоналу, и пациенты предпочитают его, а не венозную канюлю. Менее инвазивный забор крови может улучшить набор и удержание участников исследования. ( 3 ) DBS можно транспортировать и хранить при температуре окружающей среды, что устраняет необходимость в дорогостоящих морозильных камерах и транспортировке с сухим льдом.( 4 ) Антимикробная природа бумаги не требует мер по обеспечению биологической опасности при транспортировке (11). У DBS есть свои ограничения, в первую очередь неопределенность влияния уровня гематокрита крови на результаты тестов.
Гематокрит может изменять вязкость крови и влиять на результаты количественного определения с использованием DBS (12). Например, образец крови с высоким гематокритом, вероятно, более вязкий по сравнению с образцом с более низким уровнем гематокрита и может меньше растекаться на фильтровальной бумаге.В свою очередь, это может изменить количество образца, полученного при отборе пуансона фиксированного диаметра из DBS. Решением этой досадной проблемы может быть использование пятна высушенной плазмы (DPS), вязкость которого не зависит от уровня гематокрита. Соответственно, мы предположили, что ( 1 ) гематокрит будет влиять на степень растекания на фильтровальной бумаге и, следовательно, концентрацию IOT в плазме, ( 2 ) DPS будет корректировать эффект гематокрита, и ( 3 ) DPS обеспечит приемлемую корреляцию с эталонным методом определения СКФ.
Метод DPS был бы наиболее полезен в группах населения, где оценка СКФ на основе уравнений сывороточного креатинина не была адекватной, например, у пациентов с циррозом или саркопенией печени или у пациентов с крайним возрастом. Уравнения креатинина сыворотки не являются оптимальными при сравнении людей из разных популяций или среди пациентов с минимальным нарушением функции почек (13). DPS может подойти в вышеупомянутых ситуациях.
Целью данного исследования является описание разработки и валидации метода количественной оценки ВГД в плазме человека, приготовленной в виде DPS, детектируемого с помощью ВЭЖХ-тандемного ультрафиолета (УФ).Метод был подтвержден путем сравнения измеренной СКФ с использованием традиционного анализа плазмы.
Материалы и методы
Химикаты, реагенты, оборудование, приборы для ВЭЖХ-УФ и метод
Химикаты, реагенты, оборудование и приборы для ВЭЖХ-УФ были созданы с использованием ранее опубликованного метода, используемого для анализа стандартов и образцов плазмы участников (14 ). Дополнительные химикаты, реагенты и оборудование следующие. Упакованные эритроциты человека и свежезамороженная плазма поставлялись через Центр Ричарда Л.Банк крови Медицинского центра Управления ветеранов Рудебуша (Индианаполис, Индиана). Карты FTA DMPK-A, FTA DMPK-B, FTA DMPK-C, Harris 6-мм Uni-Core и 903 Specimen Protein Saver Card были получены через GE Healthcare (Бакингемшир, Великобритания).
DBS Sample Preparation
Первоначальные эксперименты показали, что результаты хроматографии схожи со всеми фильтрами. Карточки сохранения протеина 903 были самыми дешевыми; поэтому все эксперименты проводились с использованием этой бумаги.Используя регулируемую микропипетку, 15 мкл мкл крови были нанесены на центр 903 карты сохранения белка для образцов. Карточкам давали высохнуть на открытом воздухе в течение 2 часов в вертикальном положении. Карты затем переносили в эксикатор, содержащий рыхлый сухой осушитель, для дополнительной сушки в течение ночи. Диск диаметром 6 мм пробивали из пятна в микроцентрифужную пробирку объемом 2 мл; 100 мкл мкл подвижной фазы (85% 50 мМ натрий-фосфатного буфера, 10% метанола, 5% ацетонитрила).Образцы встряхивали в течение 60 минут, а затем центрифугировали в течение 2 минут при 14000 об / мин. Полученный супернатант переносили в чистую микроцентрифужную пробирку объемом 1,5 мл и центрифугировали в течение 6 минут при 14000 об / мин. Затем супернатант переносили в чистый сосуд, закрывали крышкой и анализировали с помощью ВЭЖХ-УФ.
DPS Подготовка образца
С помощью регулируемой микропипетки 15 мкл мкл плазмы были нанесены на центр карты сохранения белка для образцов 903. Остальная часть подготовки DPS соответствует контуру образцов DBS.
Влияние эффекта гематокрита на DBS
Образцы крови с определенным уровнем гематокрита (21,2% или 33,5%) получали разбавлением эритроцитов свежезамороженной плазмой. Для каждого уровня гематокрита были сделаны шесть пятен DBS, были получены цифровые изображения DBS и площадь пятна крови была определена с использованием формулы вычисления площади с использованием Photoshop Creative Suite 5 (Adobe Systems, Сан-Хосе, Калифорния). Полные стандартные кривые были построены для каждой концентрации гематокрита путем добавления IOT и нанесены пятнами.
DPS Коррекция эффекта гематокрита у отдельных лиц
Были обнаружены образцы плазмы от 10 субъектов с диапазоном гематокрита (27,9–44,8), взятые в 12 точках в течение 5 часов после болюсной инъекции ВГД. Концентрации сравнивали с образцами плазмы, не нанесенными на фильтровальную бумагу и приготовленными параллельно. График Бланда – Альтмана (разница средних) использовался для анализа соответствия между DPS и традиционными плазменными методами.
Популяция исследования
Популяция исследования состояла из 10 участников в возрасте от 41 до 82 лет со средним значением (± стандартное отклонение) 65.2 ± 13,4 года. Шесть участников были мужчинами. Пять участников были белыми, а пять — черными. Девять пациентов страдали анемией легкой степени, со средним уровнем гемоглобина 11,46 ± 1,32 г / дл и средним гематокритом 34,04 ± 4,19%. Средняя расчетная СКФ составляла 33,4 ± 10,1 мл / мин на 1,73 м 2 (диапазон = 18–55,9 мл / мин на 1,73 м 2 ). Этиология ХБП заключалась в гипертоническом нефросклерозе у четырех участников, сахарном диабете у четырех участников и обструктивной уропатии у двух участников.
Сравнение DPS с плазмой при оценке СКФ.
Были построены фармакокинетические параметры между параллельными DPS и традиционными наборами образцов участников из плазмы ( n = 10).СКФ оценивали для каждого метода и сравнивали с использованием программного обеспечения WinNonlin (Сент-Луис, Миссури) и двухфармакокинетической модели, как описано ранее (15). Опять же, график Бланда-Альтмана использовался для проверки соответствия между двумя методами.
Валидация метода: меж- и внутридневная изменчивость
Точность и прецизионность метода определяли путем анализа повторений полных стандартных кривых в течение одного и того же цикла и в шести отдельных случаях в течение 60 дней. Определены точность и прецизионность.Прецизионность определялась путем расчета коэффициента вариации (CV) в пределах 1 дня (внутридневная точность) и между днями (внутридневная точность). Точность определялась путем вычисления процента ошибки (наблюдаемое – прогнозируемое) × 100 / прогнозируемое.
Стандарт плазмы, приготовленный до концентрации, равной половине от самой нижней точки кривой (25 µ г / мл), наносили на 903 карточки ( n = 14). Были рассчитаны площади для определения обнаруживаемости и точности. Протокол был одобрен Институциональным наблюдательным советом Университета Индианы по защите людей и Комитетом по исследованиям и развитию по делам ветеранов, и каждый субъект подписал письменное информированное согласие.
Результаты
Влияние эффекта гематокрита на DBS
Площадь пятен цельной крови с гематокритом 33,5% была примерно на 10% меньше, чем пятна с гематокритом 22,2% (, вставка). Неудивительно, что стандартная кривая, полученная с гематокритом крови 22,2% и 33,5%, давала различные ответы с пиковой площадью пика ВГД (). Как и ожидалось, по сравнению с образцами с 22,2% средние наклоны площади IOT по сравнению с концентрацией в образцах с гематокритом 33,5% были на 37% больше.
Сравнение стандартных кривых концентраций иоталамата с площадью пика, измеренной с помощью ВЭЖХ, показывает, что более низкий гематокрит вызывает более низкое извлечение иоталамата. На вставке показано, что площадь, занимаемая пятном равного объема крови, больше при более низком гематокрите.
DPS Коррекция гематокритного эффекта у людей
Отношение между концентрацией IOT участников в DPS и плазме было отличным (). Регрессия концентрации, оцененной двумя методами, показала наклон 0,95, который значительно отличался от 1. Таким образом, по сравнению со стандартным методом отбора проб IOT, метод DPS дал среднюю концентрацию в парных точках выборки, которая была на 5% ниже по сравнению с плазма.График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл (, вставка). Поскольку распределение различий не было нормально распределенным, что привело к появлению мегафонного или V-образного графика, мы вычислили логарифмически преобразованные различия. Смещение составило 1,7% (95% доверительный интервал = -22,3%, 21,0%).
Показана взаимосвязь между концентрацией йоталамата у участников, полученной стандартным методом, и пятнами высушенной плазмы. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,92–0,98. На вставке показан график Бланда – Альтмана парных точек выборки ( n = 116), который показывает смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл.
Сравнение DPS с плазмой при оценке СКФ
Отношение между расчетной СКФ в DPS и плазменных методах было отличным (). Хотя регрессия СКФ, оцененная двумя методами, показала наклон 0.95, он не отличался значительно от 1, потому что 95% доверительный интервал наклона включал 1. График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от -6 до +10 мл. / мин (, Врезка).
Показана взаимосвязь между оценкой СКФ с использованием пятна высушенной плазмы и стандартным методом. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,82–1,07. На вставке показан график Бланда – Альтмана для парных точек выборки ( n = 10), который показывает смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин.
Парные концентрации ионов плазмы и DPS в зависимости от времени для каждого из 10 субъектов показаны в. Большинство измерений мало различались между методами, показанными количественно в.
Соответствие между методами показано в виде динамики кривых распада иоталамата за 300 минут для каждого из 10 субъектов. Каждая панель представляет один предмет; треугольники обозначают стандартный метод, а кружки обозначают метод DPS.
Точность и прецизионность теста – повторного тестирования
Результаты тестирования – повторного тестирования показаны на рис.Точность обычно составляла от 5% до 10%, а точность — в пределах 5%. Статистически значимые, но небольшие неточности наблюдались для самых высоких и самых низких концентраций IOT. Среднее значение CV и ошибка для каждой точки стандартной кривой находились в пределах принятых критериев валидации анализа (<15%) (15). Дневные наклоны имели CV 4,7%, тогда как дневные CV наклонов составляли 3,8%. Мы измерили площадь пика с номинальной концентрацией 25 µ мкг / мл IOT в плазме. В каждом случае четко распознавался пик IOT, и площадь пика имела CV 9.7%.
Таблица 1.
Точность и прецизионность повторных испытаний
| Номинальная концентрация йоталамата ( µ г / мл) | Средняя концентрация ( µ г / мл) | SD | Эффективная точность (% -ный коэффициент) отклонения) | Точность (% ошибки, 95% доверительный интервал) | ||||
|---|---|---|---|---|---|---|---|---|
| Проведение дневного диагностического теста | ||||||||
| 50 | 48 6 | 90.32,4 (-11,3, 1,3) | ||||||
| 100 | 96 | 7 | 6,9 | 2,7 (-10,9, 3) | ||||
| 200 | 5,3194 | 26 | (−16,5, 10,7)||||||
| 300 | 300 | 20 | 6,5 | 2,7 (−6,8, 7) | ||||
| 500 | 511 | 16 | 3,2 | 9024,1 5.7)|||||
| 1000 | 1052 | 53 | 5 | 2.2 (-0,3, 10,8) | ||||
| Производительность дневного диагностического теста | ||||||||
| 50 | 55 | 4 | 7,9 | 100 9023 | 103 | 8 | 7,9 | 3,4 (−5,2, 12) |
| 200 | 212 | 18 | 8,3 | 3,6 (−3,3, 15,2) | 27 | 8.8 | 3,7 (−5,9, 13,3) | |
| 500 | 511 | 21 | 4 | 1,7 (−2,1, 6,6) | ||||
| 1000 | 1067 | 43 4 9022 (2.2, 11.2) |
Мы можем быть осторожно уверены, что IOT стабильно в фильтровальной бумаге в течение 60 дней. Мы подготовили образцы DPS в первый день и повторно использовали эти стандарты для измерения межсуточной изменчивости. Наибольшее время среди измерений IOT составило 60 дней.В это время было хорошее согласие в измерении тест-повторный тест, как показано на.
Обсуждение
Результаты наших экспериментов показывают разработку и валидацию простого быстрого анализа для количественной оценки концентраций ВГД и последующего определения СКФ в образцах DPS человека с помощью ВЭЖХ-УФ, показывая приемлемую корреляцию с традиционной обработкой плазмы. Некоторые выводы заслуживают внимания и будут обсуждаться.
Изменение гематокрита между образцами соответствует наблюдаемому изменению размера пятна согласованных объемов (9.8%). Большее распространение образцов с более низким гематокритом вызывает большее распределение ВГД на фильтровальной бумаге. Как и ожидалось, пробойник фиксированного диаметра, взятый из пятен с разным уровнем гематокрита, эффективно отбирает разные объемы крови. Таким образом, из образцов с более низким гематокритом извлекается более низкая концентрация ВГД. Изменение площади пика IOT не соответствует линейно увеличению площади пятна и не может быть эффективно компенсировано в этом анализе. Это открытие является особенно важным ограничением DBS при использовании у людей с ХБП, у которых может быть аномально низкий уровень гематокрита.Хотя измерение клиренса ВГД для определения СКФ у участников с тяжелой анемией не является обычным делом, по сравнению с методом DBS, использование метода DPS может дать более надежные результаты, особенно среди лиц с тяжелой анемией.
Использование плазмы на фильтровальной бумаге устраняет вариабельность уровней гематокрита за счет более сложной подготовки проб. Использование DPS требует наличия центрифуги и пробирок для сбора крови для фракционирования цельной крови. Тем не менее, подготовка образцов по-прежнему проще, чем традиционный метод плазмы, поскольку устраняется необходимость в больших объемах с помощью венозной канюли, хранения и ограничений транспортировки образцов.DPS предоставил подходящую альтернативу плазме для количественного определения концентрации ВГД в плазме у участников с ХЗП.
Важным выводом нашего исследования было то, что, несмотря на большие различия в уровнях гематокрита среди участников, не наблюдалось значительных различий в расчетной концентрации ВГД между методами. Смещение в методе парной пробы плазмы по сравнению с методом DPS было низким, а точность для каждой парной временной точки между методами находилась в пределах 15%. Кроме того, рассчитанная СКФ у участников обеспечивает точность в пределах 15% между методами, показывая, что DPS является подходящей альтернативой плазме для оценки СКФ для оценки почечной гемодинамики и стадии ХБП.
Все процессы внутридневной и междневной валидации обеспечили точность и прецизионность в рамках принятых критериев валидации анализа и показали, что аналит стабилен в фильтровальной бумаге до 60 дней (16). Площади пиков образцов в плазме всего 25 µ г / мл можно было легко визуализировать, а надежность суточного теста-повторного тестирования для оценки площади пика составляла <10%.
Ограничения этого пилотного исследования включают небольшой размер выборки участников ( n = 10). Дополнительные эксперименты с участием более крупных образцов улучшили бы статистическую мощность тестов.Дополнительным ограничением является то, что используемый в настоящее время более низкий уровень гематокрита 22,2% при сравнении распространения мажущих кровянистых выделений находится на нижних границах того, что можно увидеть клинически. У стабильных пациентов с ХБП меньше шансов встретить широкий диапазон уровней гематокрита. Дополнительные эксперименты, включающие более узкие диапазоны уровней гематокрита, могут быть желательными для характеристики влияния гематокрита на восстановление DBS.
Будущие эксперименты, проведенные для преодоления эффекта гематокрита, могут расширить область применения DBS для включения участников с различным уровнем гематокрита.Обнаружение известного объема и взятие всего пятна для анализа свело бы на нет эффект распределения образца и обеспечило бы анализ фиксированного объема крови.
Таким образом, мы показываем, что DBS не подходят для исследований, в которых участвуют люди с аномальным уровнем гематокрита. Тем не менее, DPS корректируют это ограничение, и они являются надежным методом для количественной оценки IOT и последующего определения GFR. Текущий метод показывает приемлемую точность, прецизионность и надежность в соответствии с общепринятыми критериями валидации.Матрица DPS может позволить осуществлять выборку из групп населения, которые ранее были ограничены (педиатрические или тяжелобольные или пациенты, проживающие в отдаленных районах) из-за необходимости меньшего объема крови, а также обеспечивать более простые и экономичные средства хранения и транспортировки образцов. .
Раскрытие информации
R.A. входит в состав руководящих комитетов исследований, финансируемых Roche, Amgen, Celgene и Reata, а также в бюро спикеров Merck и Abbott, а также является консультантом Daichii Sankyo, Inc., Takeda Pharma и Sigma Tau.
Благодарность
Исследование было частично поддержано Национальными институтами здравоохранения (грант 5 U01-DK071633-05).
Сноски
Публикуется в Интернете перед печатью. Дата публикации доступна на сайте www.cjasn.org.
Ссылки
2. Флорийн К.В., Барендрегт Дж. Н., Лентес Э. Г., ван Дам В., Проджосуджади В., ван Заас Дж. Л., ван Эс Л. А., Чанг П. С. Измерение скорости клубочковой фильтрации с помощью однократной инъекции инулина. Почка Int 46: 252–259, 1994 [PubMed] [Google Scholar] 3.Agarwal R: Амбулаторное измерение СКФ с холодным йоталаматом у взрослых с хроническим заболеванием почек. Am J Kidney Dis 41: 752–759, 2003 [PubMed] [Google Scholar] 4. Доулинг Т.С., Фрай Р.Ф., Фрейли Д.С., Мацке Г.Р.: Сравнение методов очистки от йоталамата для измерения СКФ. Фармакотерапия 19: 943–950, 1999 [PubMed] [Google Scholar] 5. Гатри Р., Сьюзи А.: Простой метод фенилаланина для обнаружения фенилкетонурии в больших популяциях новорожденных. Педиатрия 32: 338–343, 1963 [PubMed] [Google Scholar] 6.Мей Дж. В., Александр Дж. Р., Адам Б. В., Хэннон В. Х .: Использование фильтровальной бумаги для сбора и анализа образцов цельной крови человека. J Nutr 131: 1631S – 1636S, 2001 [PubMed] [Google Scholar] 7. Li W, Tse FL: отбор проб высушенной крови в сочетании с ЖХ-МС / МС для количественного анализа малых молекул. Биомедицинский хроматограф 24: 49–65, 2010 [PubMed] [Google Scholar] 8. Нельсон К. Б., Дамброзия Дж. М., Гретер Дж. К., Филлипс Т. М.: Неонатальные цитокины и факторы свертывания крови у детей с церебральным параличом. Энн Нейрол 44: 665–675, 1998 [PubMed] [Google Scholar] 9.Патчен Л.С., Маунт Д.Л., Шварц И.К., Черчилль Ф.К .: Анализ образцов крови, абсорбированных фильтровальной бумагой, на содержание хлорохина и его основного метаболита с использованием высокоэффективной жидкостной хроматографии с флуоресцентным детектированием. J Хроматограф A 278: 81–89, 1983 [PubMed] [Google Scholar] 10. Спунер Н., Лад Р., Барфилд М.: Высушенные пятна крови как метод сбора образцов для определения фармакокинетики в клинических исследованиях: Соображения по валидации количественного биоаналитического метода.Анальный хим 81: 1557–1563, 2009 [PubMed] [Google Scholar] 12. Patel P, Mulla H, Tanna S, Pandya H: Содействие фармакокинетическим исследованиям у детей: новое использование сухих пятен крови. Арка Дис Дитя 95: 484–487, 2010 [PubMed] [Google Scholar] 13. Эрли А., Мискулин Д., Лэмб Э. Дж., Леви А. С., Улиг К.: Расчетные уравнения для скорости клубочковой фильтрации в эпоху стандартизации креатинина: систематический обзор. Энн Интерн Мед 156: 785–795, 2012 [PubMed] [Google Scholar] 14. Агарвал Р., Васавада Н., Чейз С.Д.: Жидкостная хроматография иоталамата в биологических образцах.J Chromatogr B Analyt Technol Biomed Life Sci 785: 345–352, 2003 [PubMed] [Google Scholar] 15. Agarwal R, Bills JE, Yigazu PM, Abraham T, Gizaw AB, Light RP, Bekele DM, Tegegne GG: Оценка клиренса йоталамата из плазмы: Продолжительность исследования влияет на качество СКФ. Clin J Am Soc Nephrol 4: 77–85, 2009 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Shah VP, Midha KK, Findlay JW, Hill HM, Hulse JD, McGilveray IJ, McKay G, Miller KJ, Patnaik RN, Powell ML, Tonelli A, Viswanathan CT, Yacobi A: валидация биоаналитического метода — пересмотр с десятилетним прогрессом .Pharm Res 17: 1551–1557, 2000 [PubMed] [Google Scholar]Использование высушенных плазменных пятен для количественного определения йоталамата в клинических исследованиях
Clin J Am Soc Nephrol. 2013 7 июня; 8 (6): 909–914.
, * , † и *Эндрю С. Хаган
* Школа медицины Университета Индианы и Медицинский центр Управления ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
Дэвид Р. Джонс
† Отдел клинической фармакологии, Медицинский факультет Университета Индианы, Индианаполис, Индиана
Раджив Агарвал
* Медицинский факультет Университета Индианы и Ричард Л.Медицинский центр администрации ветеранов Рудебуша, Индианаполис, Индиана; и
* Медицинский факультет Университета Индианы и Медицинский центр администрации ветеранов Ричарда Л. Рудебуша, Индианаполис, Индиана; и
† Отдел клинической фармакологии, Медицинский факультет, Школа медицины Университета Индианы, Индианаполис, Индиана
Автор, отвечающий за переписку. Для корреспонденции: Доктор Раджив Агарвал, Университет Индианы и Медицинский центр Управления ветеранов, 1481 West 10th Street, Индианаполис, IN 46202.Электронная почта: ude.iupui@lawragarПолучено 12 октября 2012 г .; Принято 11 января 2013 г.
Авторские права © Американское общество нефрологов, 2013 г. Эта статья цитируется в других статьях в PMC.Резюме
Предпосылки и цели
Хотя зазоры иоталамата широко использовались для измерения СКФ, необходимость транспортировки образцов плазмы в охлажденных условиях исключает его использование в ситуациях нехватки ресурсов. Пятна крови или плазмы, высохшие на фильтровальной бумаге, могут стать решением.
Дизайн, условия, участники и измерения
Используя проверенную методику ВЭЖХ, измеряли иоталамат в сухих пятнах крови с различными гематокритами. СКФ измеряли в течение 5 часов у 10 пациентов с ХБП с использованием пятен высушенной плазмы и стандартных методов.
Результаты
Снижение гематокрита привело к увеличению площади распространения крови и снижению извлечения йоталамата из засохших пятен крови. Однако соотношение между концентрациями иоталамата в пятнах высушенной плазмы и плазмы показало наклон регрессии, равный 0.95 (95% доверительный интервал = 0,92–0,98, P <0,001). График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 μ г / мл и пределы согласия от -38 до +30 μ г / мл. Взаимосвязь между СКФ при использовании пятен высушенной плазмы и методами плазмы также показала отличную взаимосвязь (наклон 0,95, 95% доверительный интервал = 0,82–1,17). График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин. Точность обычно составляла от 5% до 10%, а точность — в пределах 5%.
Выводы
Хотя сухие пятна крови не подходят для исследований среди пациентов с очень низким гематокритом, пятна высушенной плазмы корректируют это ограничение, и это небольшое пилотное исследование показывает, что это достаточно надежный метод количественного определения йоталамата и последующего определения СКФ. .
Введение
СКФ необходимо определить для точной оценки функции почек и стадии ХБП. Золотым стандартом для измерения СКФ считается клиренс инулина, природного полисахарида, который не секретируется и не реабсорбируется почечными канальцами (1,2).Однако инулин дорог и его не хватает; поэтому были разработаны альтернативные методы измерения СКФ (3). Одним из таких методов является измерение клиренса иоталамата (IOT) после болюсной инъекции, что обеспечивает точное и точное определение СКФ (4). Определение клиренса ВГД с помощью традиционного анализа плазмы имеет ограничения, включая необходимость венозной канюляции для отбора проб больших объемов крови, а также неотъемлемые затраты на хранение и транспортировку проб.
Возможным решением вышеуказанных ограничений является использование сухих пятен крови (DBS) на фильтровальной бумаге. Фильтровальная бумага использовалась для сбора, хранения и анализа крови человека с момента ее принятия доктором Робертом Гатри для обнаружения фенилаланина при диагностике фенилкетонурии у новорожденных в 1960-х годах (5). Последние достижения позволяют шире использовать DBS в клинических испытаниях для анализа ряда небольших молекул лекарств (6–10). К преимуществам DBS по сравнению с анализом плазмы можно отнести следующие.( 1 ) Меньший объем крови (<100 µ л) на образец делает матрицу применимой к педиатрическим или тяжелобольным пациентам, где больший объем крови может быть нежелательным. ( 2 ) Для отбора проб можно использовать уколы из пальца. Этот метод сбора крови легче выполнять персоналу, и пациенты предпочитают его, а не венозную канюлю. Менее инвазивный забор крови может улучшить набор и удержание участников исследования. ( 3 ) DBS можно транспортировать и хранить при температуре окружающей среды, что устраняет необходимость в дорогостоящих морозильных камерах и транспортировке с сухим льдом.( 4 ) Антимикробная природа бумаги не требует мер по обеспечению биологической опасности при транспортировке (11). У DBS есть свои ограничения, в первую очередь неопределенность влияния уровня гематокрита крови на результаты тестов.
Гематокрит может изменять вязкость крови и влиять на результаты количественного определения с использованием DBS (12). Например, образец крови с высоким гематокритом, вероятно, более вязкий по сравнению с образцом с более низким уровнем гематокрита и может меньше растекаться на фильтровальной бумаге.В свою очередь, это может изменить количество образца, полученного при отборе пуансона фиксированного диаметра из DBS. Решением этой досадной проблемы может быть использование пятна высушенной плазмы (DPS), вязкость которого не зависит от уровня гематокрита. Соответственно, мы предположили, что ( 1 ) гематокрит будет влиять на степень растекания на фильтровальной бумаге и, следовательно, концентрацию IOT в плазме, ( 2 ) DPS будет корректировать эффект гематокрита, и ( 3 ) DPS обеспечит приемлемую корреляцию с эталонным методом определения СКФ.
Метод DPS был бы наиболее полезен в группах населения, где оценка СКФ на основе уравнений сывороточного креатинина не была адекватной, например, у пациентов с циррозом или саркопенией печени или у пациентов с крайним возрастом. Уравнения креатинина сыворотки не являются оптимальными при сравнении людей из разных популяций или среди пациентов с минимальным нарушением функции почек (13). DPS может подойти в вышеупомянутых ситуациях.
Целью данного исследования является описание разработки и валидации метода количественной оценки ВГД в плазме человека, приготовленной в виде DPS, детектируемого с помощью ВЭЖХ-тандемного ультрафиолета (УФ).Метод был подтвержден путем сравнения измеренной СКФ с использованием традиционного анализа плазмы.
Материалы и методы
Химикаты, реагенты, оборудование, приборы для ВЭЖХ-УФ и метод
Химикаты, реагенты, оборудование и приборы для ВЭЖХ-УФ были созданы с использованием ранее опубликованного метода, используемого для анализа стандартов и образцов плазмы участников (14 ). Дополнительные химикаты, реагенты и оборудование следующие. Упакованные эритроциты человека и свежезамороженная плазма поставлялись через Центр Ричарда Л.Банк крови Медицинского центра Управления ветеранов Рудебуша (Индианаполис, Индиана). Карты FTA DMPK-A, FTA DMPK-B, FTA DMPK-C, Harris 6-мм Uni-Core и 903 Specimen Protein Saver Card были получены через GE Healthcare (Бакингемшир, Великобритания).
DBS Sample Preparation
Первоначальные эксперименты показали, что результаты хроматографии схожи со всеми фильтрами. Карточки сохранения протеина 903 были самыми дешевыми; поэтому все эксперименты проводились с использованием этой бумаги.Используя регулируемую микропипетку, 15 мкл мкл крови были нанесены на центр 903 карты сохранения белка для образцов. Карточкам давали высохнуть на открытом воздухе в течение 2 часов в вертикальном положении. Карты затем переносили в эксикатор, содержащий рыхлый сухой осушитель, для дополнительной сушки в течение ночи. Диск диаметром 6 мм пробивали из пятна в микроцентрифужную пробирку объемом 2 мл; 100 мкл мкл подвижной фазы (85% 50 мМ натрий-фосфатного буфера, 10% метанола, 5% ацетонитрила).Образцы встряхивали в течение 60 минут, а затем центрифугировали в течение 2 минут при 14000 об / мин. Полученный супернатант переносили в чистую микроцентрифужную пробирку объемом 1,5 мл и центрифугировали в течение 6 минут при 14000 об / мин. Затем супернатант переносили в чистый сосуд, закрывали крышкой и анализировали с помощью ВЭЖХ-УФ.
DPS Подготовка образца
С помощью регулируемой микропипетки 15 мкл мкл плазмы были нанесены на центр карты сохранения белка для образцов 903. Остальная часть подготовки DPS соответствует контуру образцов DBS.
Влияние эффекта гематокрита на DBS
Образцы крови с определенным уровнем гематокрита (21,2% или 33,5%) получали разбавлением эритроцитов свежезамороженной плазмой. Для каждого уровня гематокрита были сделаны шесть пятен DBS, были получены цифровые изображения DBS и площадь пятна крови была определена с использованием формулы вычисления площади с использованием Photoshop Creative Suite 5 (Adobe Systems, Сан-Хосе, Калифорния). Полные стандартные кривые были построены для каждой концентрации гематокрита путем добавления IOT и нанесены пятнами.
DPS Коррекция эффекта гематокрита у отдельных лиц
Были обнаружены образцы плазмы от 10 субъектов с диапазоном гематокрита (27,9–44,8), взятые в 12 точках в течение 5 часов после болюсной инъекции ВГД. Концентрации сравнивали с образцами плазмы, не нанесенными на фильтровальную бумагу и приготовленными параллельно. График Бланда – Альтмана (разница средних) использовался для анализа соответствия между DPS и традиционными плазменными методами.
Популяция исследования
Популяция исследования состояла из 10 участников в возрасте от 41 до 82 лет со средним значением (± стандартное отклонение) 65.2 ± 13,4 года. Шесть участников были мужчинами. Пять участников были белыми, а пять — черными. Девять пациентов страдали анемией легкой степени, со средним уровнем гемоглобина 11,46 ± 1,32 г / дл и средним гематокритом 34,04 ± 4,19%. Средняя расчетная СКФ составляла 33,4 ± 10,1 мл / мин на 1,73 м 2 (диапазон = 18–55,9 мл / мин на 1,73 м 2 ). Этиология ХБП заключалась в гипертоническом нефросклерозе у четырех участников, сахарном диабете у четырех участников и обструктивной уропатии у двух участников.
Сравнение DPS с плазмой при оценке СКФ.
Были построены фармакокинетические параметры между параллельными DPS и традиционными наборами образцов участников из плазмы ( n = 10).СКФ оценивали для каждого метода и сравнивали с использованием программного обеспечения WinNonlin (Сент-Луис, Миссури) и двухфармакокинетической модели, как описано ранее (15). Опять же, график Бланда-Альтмана использовался для проверки соответствия между двумя методами.
Валидация метода: меж- и внутридневная изменчивость
Точность и прецизионность метода определяли путем анализа повторений полных стандартных кривых в течение одного и того же цикла и в шести отдельных случаях в течение 60 дней. Определены точность и прецизионность.Прецизионность определялась путем расчета коэффициента вариации (CV) в пределах 1 дня (внутридневная точность) и между днями (внутридневная точность). Точность определялась путем вычисления процента ошибки (наблюдаемое – прогнозируемое) × 100 / прогнозируемое.
Стандарт плазмы, приготовленный до концентрации, равной половине от самой нижней точки кривой (25 µ г / мл), наносили на 903 карточки ( n = 14). Были рассчитаны площади для определения обнаруживаемости и точности. Протокол был одобрен Институциональным наблюдательным советом Университета Индианы по защите людей и Комитетом по исследованиям и развитию по делам ветеранов, и каждый субъект подписал письменное информированное согласие.
Результаты
Влияние эффекта гематокрита на DBS
Площадь пятен цельной крови с гематокритом 33,5% была примерно на 10% меньше, чем пятна с гематокритом 22,2% (, вставка). Неудивительно, что стандартная кривая, полученная с гематокритом крови 22,2% и 33,5%, давала различные ответы с пиковой площадью пика ВГД (). Как и ожидалось, по сравнению с образцами с 22,2% средние наклоны площади IOT по сравнению с концентрацией в образцах с гематокритом 33,5% были на 37% больше.
Сравнение стандартных кривых концентраций иоталамата с площадью пика, измеренной с помощью ВЭЖХ, показывает, что более низкий гематокрит вызывает более низкое извлечение иоталамата. На вставке показано, что площадь, занимаемая пятном равного объема крови, больше при более низком гематокрите.
DPS Коррекция гематокритного эффекта у людей
Отношение между концентрацией IOT участников в DPS и плазме было отличным (). Регрессия концентрации, оцененной двумя методами, показала наклон 0,95, который значительно отличался от 1. Таким образом, по сравнению со стандартным методом отбора проб IOT, метод DPS дал среднюю концентрацию в парных точках выборки, которая была на 5% ниже по сравнению с плазма.График Бланда – Альтмана парных точек выборки ( n = 116) показал смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл (, вставка). Поскольку распределение различий не было нормально распределенным, что привело к появлению мегафонного или V-образного графика, мы вычислили логарифмически преобразованные различия. Смещение составило 1,7% (95% доверительный интервал = -22,3%, 21,0%).
Показана взаимосвязь между концентрацией йоталамата у участников, полученной стандартным методом, и пятнами высушенной плазмы. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,92–0,98. На вставке показан график Бланда – Альтмана парных точек выборки ( n = 116), который показывает смещение -4 µ г / мл и пределы согласия от -38 до +30 µ г / мл.
Сравнение DPS с плазмой при оценке СКФ
Отношение между расчетной СКФ в DPS и плазменных методах было отличным (). Хотя регрессия СКФ, оцененная двумя методами, показала наклон 0.95, он не отличался значительно от 1, потому что 95% доверительный интервал наклона включал 1. График Бланда – Альтмана парных СКФ показал смещение 2 мл / мин с пределами согласия от -6 до +10 мл. / мин (, Врезка).
Показана взаимосвязь между оценкой СКФ с использованием пятна высушенной плазмы и стандартным методом. Регрессия концентрации, оцененной двумя методами, показала наклон 0,95 с доверительным интервалом 0,82–1,07. На вставке показан график Бланда – Альтмана для парных точек выборки ( n = 10), который показывает смещение 2 мл / мин с пределами согласия от –6 до +10 мл / мин.
Парные концентрации ионов плазмы и DPS в зависимости от времени для каждого из 10 субъектов показаны в. Большинство измерений мало различались между методами, показанными количественно в.
Соответствие между методами показано в виде динамики кривых распада иоталамата за 300 минут для каждого из 10 субъектов. Каждая панель представляет один предмет; треугольники обозначают стандартный метод, а кружки обозначают метод DPS.
Точность и прецизионность теста – повторного тестирования
Результаты тестирования – повторного тестирования показаны на рис.Точность обычно составляла от 5% до 10%, а точность — в пределах 5%. Статистически значимые, но небольшие неточности наблюдались для самых высоких и самых низких концентраций IOT. Среднее значение CV и ошибка для каждой точки стандартной кривой находились в пределах принятых критериев валидации анализа (<15%) (15). Дневные наклоны имели CV 4,7%, тогда как дневные CV наклонов составляли 3,8%. Мы измерили площадь пика с номинальной концентрацией 25 µ мкг / мл IOT в плазме. В каждом случае четко распознавался пик IOT, и площадь пика имела CV 9.7%.
Таблица 1.
Точность и прецизионность повторных испытаний
| Номинальная концентрация йоталамата ( µ г / мл) | Средняя концентрация ( µ г / мл) | SD | Эффективная точность (% -ный коэффициент) отклонения) | Точность (% ошибки, 95% доверительный интервал) | ||||
|---|---|---|---|---|---|---|---|---|
| Проведение дневного диагностического теста | ||||||||
| 50 | 48 6 | 90.32,4 (-11,3, 1,3) | ||||||
| 100 | 96 | 7 | 6,9 | 2,7 (-10,9, 3) | ||||
| 200 | 5,3194 | 26 | (−16,5, 10,7)||||||
| 300 | 300 | 20 | 6,5 | 2,7 (−6,8, 7) | ||||
| 500 | 511 | 16 | 3,2 | 9024,1 5.7)|||||
| 1000 | 1052 | 53 | 5 | 2.2 (-0,3, 10,8) | ||||
| Производительность дневного диагностического теста | ||||||||
| 50 | 55 | 4 | 7,9 | 100 9023 | 103 | 8 | 7,9 | 3,4 (−5,2, 12) |
| 200 | 212 | 18 | 8,3 | 3,6 (−3,3, 15,2) | 27 | 8.8 | 3,7 (−5,9, 13,3) | |
| 500 | 511 | 21 | 4 | 1,7 (−2,1, 6,6) | ||||
| 1000 | 1067 | 43 4 9022 (2.2, 11.2) |
Мы можем быть осторожно уверены, что IOT стабильно в фильтровальной бумаге в течение 60 дней. Мы подготовили образцы DPS в первый день и повторно использовали эти стандарты для измерения межсуточной изменчивости. Наибольшее время среди измерений IOT составило 60 дней.В это время было хорошее согласие в измерении тест-повторный тест, как показано на.
Обсуждение
Результаты наших экспериментов показывают разработку и валидацию простого быстрого анализа для количественной оценки концентраций ВГД и последующего определения СКФ в образцах DPS человека с помощью ВЭЖХ-УФ, показывая приемлемую корреляцию с традиционной обработкой плазмы. Некоторые выводы заслуживают внимания и будут обсуждаться.
Изменение гематокрита между образцами соответствует наблюдаемому изменению размера пятна согласованных объемов (9.8%). Большее распространение образцов с более низким гематокритом вызывает большее распределение ВГД на фильтровальной бумаге. Как и ожидалось, пробойник фиксированного диаметра, взятый из пятен с разным уровнем гематокрита, эффективно отбирает разные объемы крови. Таким образом, из образцов с более низким гематокритом извлекается более низкая концентрация ВГД. Изменение площади пика IOT не соответствует линейно увеличению площади пятна и не может быть эффективно компенсировано в этом анализе. Это открытие является особенно важным ограничением DBS при использовании у людей с ХБП, у которых может быть аномально низкий уровень гематокрита.Хотя измерение клиренса ВГД для определения СКФ у участников с тяжелой анемией не является обычным делом, по сравнению с методом DBS, использование метода DPS может дать более надежные результаты, особенно среди лиц с тяжелой анемией.
Использование плазмы на фильтровальной бумаге устраняет вариабельность уровней гематокрита за счет более сложной подготовки проб. Использование DPS требует наличия центрифуги и пробирок для сбора крови для фракционирования цельной крови. Тем не менее, подготовка образцов по-прежнему проще, чем традиционный метод плазмы, поскольку устраняется необходимость в больших объемах с помощью венозной канюли, хранения и ограничений транспортировки образцов.DPS предоставил подходящую альтернативу плазме для количественного определения концентрации ВГД в плазме у участников с ХЗП.
Важным выводом нашего исследования было то, что, несмотря на большие различия в уровнях гематокрита среди участников, не наблюдалось значительных различий в расчетной концентрации ВГД между методами. Смещение в методе парной пробы плазмы по сравнению с методом DPS было низким, а точность для каждой парной временной точки между методами находилась в пределах 15%. Кроме того, рассчитанная СКФ у участников обеспечивает точность в пределах 15% между методами, показывая, что DPS является подходящей альтернативой плазме для оценки СКФ для оценки почечной гемодинамики и стадии ХБП.
Все процессы внутридневной и междневной валидации обеспечили точность и прецизионность в рамках принятых критериев валидации анализа и показали, что аналит стабилен в фильтровальной бумаге до 60 дней (16). Площади пиков образцов в плазме всего 25 µ г / мл можно было легко визуализировать, а надежность суточного теста-повторного тестирования для оценки площади пика составляла <10%.
Ограничения этого пилотного исследования включают небольшой размер выборки участников ( n = 10). Дополнительные эксперименты с участием более крупных образцов улучшили бы статистическую мощность тестов.Дополнительным ограничением является то, что используемый в настоящее время более низкий уровень гематокрита 22,2% при сравнении распространения мажущих кровянистых выделений находится на нижних границах того, что можно увидеть клинически. У стабильных пациентов с ХБП меньше шансов встретить широкий диапазон уровней гематокрита. Дополнительные эксперименты, включающие более узкие диапазоны уровней гематокрита, могут быть желательными для характеристики влияния гематокрита на восстановление DBS.
Будущие эксперименты, проведенные для преодоления эффекта гематокрита, могут расширить область применения DBS для включения участников с различным уровнем гематокрита.Обнаружение известного объема и взятие всего пятна для анализа свело бы на нет эффект распределения образца и обеспечило бы анализ фиксированного объема крови.
Таким образом, мы показываем, что DBS не подходят для исследований, в которых участвуют люди с аномальным уровнем гематокрита. Тем не менее, DPS корректируют это ограничение, и они являются надежным методом для количественной оценки IOT и последующего определения GFR. Текущий метод показывает приемлемую точность, прецизионность и надежность в соответствии с общепринятыми критериями валидации.Матрица DPS может позволить осуществлять выборку из групп населения, которые ранее были ограничены (педиатрические или тяжелобольные или пациенты, проживающие в отдаленных районах) из-за необходимости меньшего объема крови, а также обеспечивать более простые и экономичные средства хранения и транспортировки образцов. .
Раскрытие информации
R.A. входит в состав руководящих комитетов исследований, финансируемых Roche, Amgen, Celgene и Reata, а также в бюро спикеров Merck и Abbott, а также является консультантом Daichii Sankyo, Inc., Takeda Pharma и Sigma Tau.
Благодарность
Исследование было частично поддержано Национальными институтами здравоохранения (грант 5 U01-DK071633-05).
Сноски
Публикуется в Интернете перед печатью. Дата публикации доступна на сайте www.cjasn.org.
Ссылки
2. Флорийн К.В., Барендрегт Дж. Н., Лентес Э. Г., ван Дам В., Проджосуджади В., ван Заас Дж. Л., ван Эс Л. А., Чанг П. С. Измерение скорости клубочковой фильтрации с помощью однократной инъекции инулина. Почка Int 46: 252–259, 1994 [PubMed] [Google Scholar] 3.Agarwal R: Амбулаторное измерение СКФ с холодным йоталаматом у взрослых с хроническим заболеванием почек. Am J Kidney Dis 41: 752–759, 2003 [PubMed] [Google Scholar] 4. Доулинг Т.С., Фрай Р.Ф., Фрейли Д.С., Мацке Г.Р.: Сравнение методов очистки от йоталамата для измерения СКФ. Фармакотерапия 19: 943–950, 1999 [PubMed] [Google Scholar] 5. Гатри Р., Сьюзи А.: Простой метод фенилаланина для обнаружения фенилкетонурии в больших популяциях новорожденных. Педиатрия 32: 338–343, 1963 [PubMed] [Google Scholar] 6.Мей Дж. В., Александр Дж. Р., Адам Б. В., Хэннон В. Х .: Использование фильтровальной бумаги для сбора и анализа образцов цельной крови человека. J Nutr 131: 1631S – 1636S, 2001 [PubMed] [Google Scholar] 7. Li W, Tse FL: отбор проб высушенной крови в сочетании с ЖХ-МС / МС для количественного анализа малых молекул. Биомедицинский хроматограф 24: 49–65, 2010 [PubMed] [Google Scholar] 8. Нельсон К. Б., Дамброзия Дж. М., Гретер Дж. К., Филлипс Т. М.: Неонатальные цитокины и факторы свертывания крови у детей с церебральным параличом. Энн Нейрол 44: 665–675, 1998 [PubMed] [Google Scholar] 9.Патчен Л.С., Маунт Д.Л., Шварц И.К., Черчилль Ф.К .: Анализ образцов крови, абсорбированных фильтровальной бумагой, на содержание хлорохина и его основного метаболита с использованием высокоэффективной жидкостной хроматографии с флуоресцентным детектированием. J Хроматограф A 278: 81–89, 1983 [PubMed] [Google Scholar] 10. Спунер Н., Лад Р., Барфилд М.: Высушенные пятна крови как метод сбора образцов для определения фармакокинетики в клинических исследованиях: Соображения по валидации количественного биоаналитического метода.Анальный хим 81: 1557–1563, 2009 [PubMed] [Google Scholar] 12. Patel P, Mulla H, Tanna S, Pandya H: Содействие фармакокинетическим исследованиям у детей: новое использование сухих пятен крови. Арка Дис Дитя 95: 484–487, 2010 [PubMed] [Google Scholar] 13. Эрли А., Мискулин Д., Лэмб Э. Дж., Леви А. С., Улиг К.: Расчетные уравнения для скорости клубочковой фильтрации в эпоху стандартизации креатинина: систематический обзор. Энн Интерн Мед 156: 785–795, 2012 [PubMed] [Google Scholar] 14. Агарвал Р., Васавада Н., Чейз С.Д.: Жидкостная хроматография иоталамата в биологических образцах.J Chromatogr B Analyt Technol Biomed Life Sci 785: 345–352, 2003 [PubMed] [Google Scholar] 15. Agarwal R, Bills JE, Yigazu PM, Abraham T, Gizaw AB, Light RP, Bekele DM, Tegegne GG: Оценка клиренса йоталамата из плазмы: Продолжительность исследования влияет на качество СКФ. Clin J Am Soc Nephrol 4: 77–85, 2009 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Shah VP, Midha KK, Findlay JW, Hill HM, Hulse JD, McGilveray IJ, McKay G, Miller KJ, Patnaik RN, Powell ML, Tonelli A, Viswanathan CT, Yacobi A: валидация биоаналитического метода — пересмотр с десятилетним прогрессом .Pharm Res 17: 1551–1557, 2000 [PubMed] [Google Scholar]Использование сухих пятен крови для определения концентрации невирапина и эфавиренца в плазме | Журнал антимикробной химиотерапии
Аннотация
Цели
Концентрации в плазме часто используются для терапевтического мониторинга антиретровирусных препаратов. Взятие сухих капель крови — удобная для пациента и простая альтернатива забору образцов плазмы. Однако концентрации сухих пятен крови не обязательно равны концентрациям в плазме, и поэтому целью данной работы было установить взаимосвязь между невирапином и эфавиренцем в сухих пятнах крови и концентрациями в плазме, чтобы облегчить клиническую реализацию отбора проб высушенной крови.
Методы
Парные сухие пятна крови и образцы плазмы были получены от 40 ВИЧ-инфицированных пациентов, получавших невирапин, и 40 пациентов, получавших эфавиренз. Все образцы были проанализированы с использованием проверенных методов ВЭЖХ – тандемной масс-спектрометрии для двух матриц. Теоретические концентрации в плазме рассчитывали из концентраций высушенных пятен крови по формуле [концентрация высушенных пятен крови / (1 — гематокрит)] × фракция, связанная с белками плазмы = концентрация в плазме. Для сравнения двух методов использовались линейная регрессия и анализ Бланда – Альтмана.
Результаты
Концентрации невирапина и эфавиренца в сухих пятнах крови и плазме хорошо коррелировали ( r 2 = 0,867 и 0,972 соответственно), хотя концентрации эфавиренца в сухих пятнах крови были на 39,8% (стандартное отклонение 7,1%) ниже, чем концентрации в плазме. . Теоретические концентрации в плазме (с использованием гематокрита для конкретного пациента) невирапина и эфавиренца были аналогичны измеренным концентрациям в плазме со средней разницей между двумя методами 0,29 мг / л (стандартное отклонение 1.35 мг / л) и 0,08 мг / л (стандартное отклонение 0,31 мг / л) соответственно.
Выводы
Концентрации невирапина и эфавиренца в сухих пятнах крови были равны концентрациям в плазме после поправки на гематокрит и связывание с конкретным соединением с белками плазмы и поэтому могут использоваться в клинической практике.
Введение
В настоящее время около 33,3 миллиона человек живут с ВИЧ. 1 После введения комбинированного антиретровирусного лечения (АРТ) заболеваемость и смертность ВИЧ-инфицированных резко снизились.Рекомендации Европейского клинического общества по СПИДу и Министерства здравоохранения и социальных служб США рекомендуют лечение ВИЧ двумя нуклеозидными ингибиторами обратной транскриптазы в сочетании с ингибитором протеазы, ненуклеозидным ингибитором обратной транскриптазы (ННИОТ) или ралтегравиром. 2,3 К сожалению, появление резистентности и возникновение побочных эффектов часто ограничивают терапевтический успех антиретровирусных препаратов.
Концентрации в плазме ННИОТ невирапина и эфавиренца были связаны с вирусологическим исходом и токсичностью у ВИЧ-инфицированных пациентов. 4,5 Таким образом, терапевтический мониторинг лекарственных средств (TDM) невирапина и эфавиренца рекомендуется в особых группах населения (например, дети и беременные женщины) и по отдельным показаниям (например, определенные лекарственные взаимодействия), чтобы минимизировать токсичность и максимизировать вирусологический результат. 6
В настоящее время TDM выполняется путем измерения концентраций в плазме. Однако отбор венозных проб имеет ряд недостатков, в том числе необходимость в обученном персонале и специализированном оборудовании для обработки проб.Кроме того, для TDM часто рекомендуется измерение минимальных уровней, что трудно выполнить в амбулаторных условиях с текущими режимами дозирования (один или два раза в день) антиретровирусных препаратов.
Сухие пятна крови (DBS) — удобная и легкая альтернатива. Пациенты могут забрать DBS простым уколом пальца, после чего кровь собирается на фильтровальные бумажные карты. Этот метод ранее использовался для TDM некоторых других препаратов. 7 Карты можно хранить при комнатной температуре после сушки на воздухе.
Однако, прежде чем использование DBS может быть реализовано в клинической практике, необходимо сравнение между DBS и концентрациями в плазме, поскольку концентрации DBS не обязательно равны концентрациям в плазме. Например, доля аналита, связанного с белками плазмы ( f bpp ), и гематокрит могут влиять на концентрацию DBS. 8,9 Таким образом, целью данной работы было сравнение концентраций невирапина и эфавиренца в DBS и плазме с использованием двух ранее утвержденных методов ВЭЖХ – тандемной масс-спектрометрии (МС / МС), разработанных для этих матриц. 10,11
Методы
Пациенты
Для этого исследования было набрано 40 ВИЧ-инфицированных пациентов, получавших режим эфавиренца, и 40 ВИЧ-инфицированных пациентов, получавших невирапин, из амбулаторной клиники больницы Slotervaart, Амстердам, Нидерланды. Количество пациентов было основано на рекомендациях по сравнению методов и оценке систематической ошибки с использованием выборок пациентов из CLSI. 12 Никаких дополнительных критериев включения, кроме схемы, не использовалось.Пациенты были набраны в период с декабря 2010 года по май 2011 года. Характеристики пациентов были получены из файлов пациентов. Кроме того, пациентов спрашивали о сроках последнего приема эфавиренца или невирапина. Это исследование было одобрено местным комитетом по этике, и каждый участник дал информированное согласие перед забором крови.
Отбор проб
образцов DBS были получены в течение 5 минут после венепункции для сбора цельной крови с ЭДТА от каждого пациента во время регулярных посещений поликлиники.Образцы плазмы получали из образцов цельной крови с ЭДТА после центрифугирования и хранили при -20 ° C до дальнейшего анализа. После стерильной очистки кожи был произведен прокол ланцета для отбора проб DBS. Первую каплю крови отбрасывали, а последующие капли крови собирали на бумажных фильтрах (карта Protein Saver 903, Whatman Nederland B.V., Ден Бош, Нидерланды). После сушки на воздухе в течение ночи образцы DBS хранили при комнатной температуре в пакете из фольги с упаковкой с влагопоглотителем в соответствии с инструкциями производителя до дальнейшего анализа.
Биоанализ
Биоанализ концентраций невирапина и эфавиренца был выполнен с использованием двух ранее утвержденных анализов ВЭЖХ – МС / МС для определения ННИОТ и ингибиторов протеаз в плазме и DBS. 10,11 Короче говоря, предварительная обработка образца плазмы состояла из осаждения белка смесью метанола и ацетонитрила (50: 50, об. / Об.), Которая содержала внутренние стандарты. Для DBS аналиты экстрагировали с перфорированного диска диаметром 0,6 см, соответствующего ∼15 мкл цельной крови, с использованием смеси метанола, ацетонитрила и 0.2 M сульфат цинка в воде (1: 1: 2, об. / Об. / Об.) С внутренними стандартами. Хроматографическое разделение проводили на колонке C18 с обращенной фазой со ступенчатым градиентом с использованием подвижной фазы, состоящей из метанола с 10 мМ буфером ацетата аммония pH 5 (35:65, об. / Об.) И метанола. Тройной квадрупольный масс-спектрометр API 3000, работающий в режиме положительной ионизации, использовали для количественного определения невирапина и эфавиренца (массовые переходы 267/226 и 316/244 m / z , соответственно).Для определения невирапина и эфавиренца в плазме были приготовлены калибровочные стандарты и стандарты контроля качества в плазме. Анализ был валидирован в диапазоне 0,1–20 мг / л с точностью от 89,8% до 99,9% и погрешностью <8,1%. Скорость восстановления была высокой и воспроизводимой (82,5–99,6%, стандартное отклонение ≤4,7% и 85,3–97,2%, стандартное отклонение ≤6,2%, для невирапина и эфавиренца, соответственно), а подавление ионов было <10% для обоих соединений. Для метода DBS образцы для калибровки и контроля качества были свежеприготовлены в DBS.Утвержденный диапазон для метода DBS был аналогичен диапазону для метода плазмы, с точностью и неточностью от 98,3% до 104,2% и от 3,4% до 12,3%, соответственно. Скорость восстановления была высокой и воспроизводимой (100,1–103,6%, стандартное отклонение ≤15,3% и 101,8% –104,4%, стандартное отклонение ≤17,5% для невирапина и эфавиренца, соответственно), а подавление ионов оказалось незначительным. Невирапин и эфавиренц были стабильны в течение не менее 7 месяцев в DBS при хранении при комнатной температуре в пакете из фольги с влагопоглотителем (наши собственные неопубликованные данные о стабильности).
Статистика
Характеристики пациентов были описаны с использованием стандартных описательных методов. DBS и концентрации в плазме сравнивали с использованием линейной регрессии. Кроме того, теоретические концентрации в плазме рассчитывали из концентраций DBS по следующей формуле: [DBS [аналит] / (1 — гематокрит)] × f bpp = [аналит] в плазме. f bpp было 0,6 и 0.995 для невирапина и эфавиренца соответственно. 13 Чтобы упростить использование этого метода в клинической практике, теоретические концентрации в плазме были рассчитаны на основе концентраций DBS с использованием среднего значения гематокрита для мужчин (0,45 л / л), поскольку наша амбулаторная популяция ВИЧ состоит в основном из мужчин. 14 Обе теоретические концентрации в плазме сравнивались с измеренными концентрациями в плазме с использованием линейной регрессии и подхода Бланда – Альтмана. 15 Парный тест t использовался для оценки различий между теоретическими концентрациями в плазме с использованием гематокрита для конкретного пациента и средних значений гематокрита для мужчин.Кроме того, измеренные концентрации эфавиренца в плазме, а также теоретические концентрации эфавиренца в плазме с использованием гематокрита для конкретного пациента или среднего гематокрита мужчин были отнесены к категории в соответствии с международным консенсусом по TDM эфавиренца, чтобы продемонстрировать клиническую применимость выборки DBS. 2 Уровни в плазме <1,0 мг / л увеличивают вероятность вирусологической недостаточности, в то время как побочные эффекты со стороны центральной нервной системы усиливаются при уровнях в плазме> 4,0 мг / л. Уровни плазмы между 1.0 и 4,0 мг / л считаются адекватными. Парные результаты сравнивались на предмет расхождений в классификации, которые могли привести к другому клиническому вмешательству. Категоризация невирапина не проводилась, поскольку терапевтический диапазон не установлен для суточной дозы 400 мг.
Результаты
Пациентов
Характеристики 80 включенных пациентов суммированы в таблице 1. Большинство пациентов были мужчинами (94%) с хорошим иммунологическим и вирусологическим статусом.Ни у одного из включенных пациентов вирусная нагрузка не превышала 50 копий / мл. Среднее количество клеток CD4 составляло 621 клетка / мм 3 (диапазон 116-1560 клеток / мм 3 ). Что касается эфавиренца, все пациенты получали одобренную дозу 600 мг один раз в сутки. Что касается невирапина, большинство пациентов ( n = 28) получали дозу 400 мг один раз в сутки, 11 пациентов получали одобренную дозу 200 мг два раза в сутки и 1 пациент принимал дозу 500 мг один раз в сутки. Наиболее часто используемым остовом аналогов нуклеозидов был тенофовир / эмтрицитабин ( n = 58).Другими нуклеозидными скелетами были ламивудин / тенофовир ( n = 5), абакавир / ламивудин ( n = 4), зидовудин / ламивудин ( n = 8), тенофовир ( n = 3), тенофовир / абакавир ( n = 1) и ламивудин ( n = 1). Ралтегравир вводили одновременно двум пациентам, тогда как усиленные атазанавир и саквинавир одновременно вводили одному пациенту.
Таблица 1.Характеристики пациентов из 80 включенных пациентов (40 на лечении невирапином и 40 на лечении эфавиренцем)
| Характеристика . | Невирапин, n = 40 . | эфавиренц, n = 40 . |
|---|---|---|
| Наружный, нет. (%) субъектов | 38 (95) | 37 (92,5) |
| Возраст (лет), средний (диапазон) | 52 (29–74) | 49 (29–64) |
| Уровень РНК ВИЧ, № (%) субъектов | ||
| <20 копий / мл | 37 (92.5) | 36 (90) |
| ≥20 до <50 копий / мл | 3 (7,5) | 4 (10) |
| Число CD4 / мм 3 , нет. (%) субъектов | ||
| <200 | 0 (0) | 2 (5) |
| ≥200 до <350 | 5 (12,5) | 4 (10) |
| ≥350 | 35 (87,5) | 34 (85) |
| Гематокрит (л / л), среднее (диапазон) | 0.43 (0,34–0,49) | 0,43 (0,32–0,49) |
| Альбумин (г / л), среднее значение (диапазон) | 43 (38–50) | 40 (33–45) |
| Характеристика . | Невирапин, n = 40 . | эфавиренц, n = 40 . |
|---|---|---|
| Наружный, нет. (%) субъектов | 38 (95) | 37 (92,5) |
| Возраст (лет), средний (диапазон) | 52 (29–74) | 49 (29–64) |
| Уровень РНК ВИЧ, №(%) субъектов | ||
| <20 копий / мл | 37 (92,5) | 36 (90) |
| ≥20 до <50 копий / мл | 3 (7,5) | 4 (10) |
| Число CD4 / мм 3 , шт. (%) субъектов | ||
| <200 | 0 (0) | 2 (5) |
| ≥200 до <350 | 5 (12,5) | 4 (10) |
| ≥350 | 35 (87.5) | 34 (85) |
| Гематокрит (л / л), среднее (диапазон) | 0,43 (0,34–0,49) | 0,43 (0,32–0,49) |
| Альбумин (г / л), среднее (диапазон) | 43 (38–50) | 40 (33–45) |
Характеристики пациентов из 80 включенных пациентов (40 на лечении невирапином и 40 на лечении эфавиренцем)
| Характеристика . | Невирапин, n = 40 . | эфавиренц, n = 40 . |
|---|---|---|
| Наружный, нет. (%) субъектов | 38 (95) | 37 (92,5) |
| Возраст (лет), средний (диапазон) | 52 (29–74) | 49 (29–64) |
| Уровень РНК ВИЧ, № (%) субъектов | ||
| <20 копий / мл | 37 (92,5) | 36 (90) |
| ≥20 до <50 копий / мл | 3 (7.5) | 4 (10) |
| Число CD4 / мм 3 , шт. (%) субъектов | ||
| <200 | 0 (0) | 2 (5) |
| ≥200 до <350 | 5 (12,5) | 4 (10) |
| ≥350 | 35 (87,5) | 34 (85) |
| Гематокрит (л / л), среднее значение (диапазон) | 0,43 (0,34–0,49) | 0,43 (0,32–0,49) |
| Альбумин (г / л), среднее (диапазон) | 43 (38–50) | 40 (33–45) |
| Характеристика . | Невирапин, n = 40 . | эфавиренц, n = 40 . |
|---|---|---|
| Наружный, нет. (%) субъектов | 38 (95) | 37 (92,5) |
| Возраст (лет), средний (диапазон) | 52 (29–74) | 49 (29–64) |
| Уровень РНК ВИЧ, № (%) субъектов | ||
| <20 копий / мл | 37 (92.5) | 36 (90) |
| ≥20 до <50 копий / мл | 3 (7,5) | 4 (10) |
| Число CD4 / мм 3 , нет. (%) субъектов | ||
| <200 | 0 (0) | 2 (5) |
| ≥200 до <350 | 5 (12,5) | 4 (10) |
| ≥350 | 35 (87,5) | 34 (85) |
| Гематокрит (л / л), среднее (диапазон) | 0.43 (0,34–0,49) | 0,43 (0,32–0,49) |
| Альбумин (г / л), среднее значение (диапазон) | 43 (38–50) | 40 (33–45) |
DBS в сравнении с концентрациями в плазме
Отношения между концентрациями невирапина и эфавиренца в DBS и плазме показаны на рисунке 1 и показали хорошие корреляции ( r 2 = 0,867 и 0,972 для невирапина и эфавиренца, соответственно). Однако концентрация DBS эфавиренца составляла 39.На 8% (стандартное отклонение 7,1%) ниже, чем соответствующие концентрации в плазме. Для невирапина DBS и соответствующие концентрации в плазме были почти идентичными. Линейная зависимость между теоретическими концентрациями невирапина и эфавиренца в плазме {с использованием формулы [DBS [аналит] / (1 — гематокрит)] × f bpp = [аналит] в плазме с гематокритом пациента} и измерена концентрации в плазме показаны на рис. 2 (а) и 2 (б), соответственно. Отношения почти соответствовали линии истинной идентичности.При использовании среднего гематокрита для мужчин для расчета теоретической концентрации в плазме наблюдались аналогичные графики ( r 2 = 0,867 и 0,972 для невирапина и эфавиренца, соответственно). На рисунке 3 показаны графики Бланда – Альтмана для обоих соединений с использованием гематокрита для конкретного пациента и среднего гематокрита для мужчин. Средняя разница в концентрациях невирапина и эфавиренца между теоретической концентрацией в плазме с использованием гематокрита для конкретного пациента и измеренной концентрацией в плазме составила 0.29 мг / л (стандартное отклонение 1,35 мг / л) и 0,08 мг / л (стандартное отклонение 0,31 мг / л), соответственно, тогда как эта разница составила 0,43 мг / л (стандартное отклонение 1,21 мг / л) и 0,17 мг / л (стандартное отклонение 0,29 мг. / L) при использовании среднего гематокрита для мужчин. Средние различия между этими двумя методами достоверно различались как для невирапина, так и для эфавиренца ( P = 0,007 и 0,009, соответственно). В таблице 2 показаны расхождения в классификации эфавиренца. В 10% ( n = 4) случаев теоретические концентрации в плазме были классифицированы иначе, чем соответствующие концентрации в плазме.
Таблица 2.Сравнение 40 образцов, классифицированных с использованием теоретических концентраций эфавиренца в плазме и измеренных концентраций в плазме
| . | . | Теоретические уровни в плазме с использованием гематокрита для конкретного пациента (средний мужской гематокрит) . | ||
|---|---|---|---|---|
| . | . | <1,0 (мг / л) . | > 1,0 и <4,0 (мг / л) . | > 4,0 (мг / л) . |
| Уровни в плазме | <1,0 (мг / л) | 2 (2) | 1 (1) | 0 (0) |
| > 1,0 и <4,0 (мг / л) ) | 1 (1) | 36 (36) | 1 (1) | |
| > 4,0 (мг / л) | 0 (0) | 1 (1) | 2 (2) | |
| . | . | Теоретические уровни в плазме с использованием гематокрита для конкретного пациента (средний мужской гематокрит) . | ||
|---|---|---|---|---|
| . | . | <1,0 (мг / л) . | > 1,0 и <4,0 (мг / л) . | > 4,0 (мг / л) . |
| Уровни в плазме | <1,0 (мг / л) | 2 (2) | 1 (1) | 0 (0) |
| > 1.0 и <4,0 (мг / л) | 1 (1) | 36 (36) | 1 (1) | |
| > 4,0 (мг / л) | 0 (0) | 1 (1) | 2 (2) | |
Сравнение 40 образцов, классифицированных с использованием теоретических концентраций эфавиренца в плазме, и измеренных концентраций в плазме
| . | . | Теоретические уровни в плазме с использованием гематокрита для конкретного пациента (средний мужской гематокрит) . | ||
|---|---|---|---|---|
| . | . | <1,0 (мг / л) . | > 1,0 и <4,0 (мг / л) . | > 4,0 (мг / л) . |
| Уровни в плазме | <1,0 (мг / л) | 2 (2) | 1 (1) | 0 (0) |
| > 1,0 и <4,0 (мг / л) ) | 1 (1) | 36 (36) | 1 (1) | |
| > 4.0 (мг / л) | 0 (0) | 1 (1) | 2 (2) | |
| . | . | Теоретические уровни в плазме с использованием гематокрита для конкретного пациента (средний мужской гематокрит) . | ||
|---|---|---|---|---|
| . | . | <1,0 (мг / л) . | > 1,0 и <4,0 (мг / л) . | > 4,0 (мг / л) . |
| Уровни в плазме | <1,0 (мг / л) | 2 (2) | 1 (1) | 0 (0) |
| > 1,0 и <4,0 (мг / л) ) | 1 (1) | 36 (36) | 1 (1) | |
| > 4,0 (мг / л) | 0 (0) | 1 (1) | 2 (2) | |
Рисунок 1.
Концентрации DBS в зависимости от концентрации в плазме для (а) невирапина и (б) эфавиренца. Прерывистая линия — это линия истинной идентичности.
Рисунок 1.
КонцентрацииDBS в зависимости от плазменных концентраций для (а) невирапина и (б) эфавиренца. Прерывистая линия — это линия истинной идентичности.
Рисунок 2.
Теоретические концентрации в плазме в зависимости от измеренных концентраций в плазме для (а) невирапина и (б) эфавиренца.Прерывистая линия — это линия истинной идентичности.
Рис. 2.
Теоретические концентрации в плазме в зависимости от измеренных концентраций в плазме для (а) невирапина и (б) эфавиренца. Прерывистая линия — это линия истинной идентичности.
Рисунок 3.
Графики Бланда – Альтмана для (а) концентраций невирапина и (б) эфавиренца с использованием измеренного гематокрита и (в) концентраций невирапина и (г) эфавиренца с использованием среднего гематокрита мужчин. Непрерывная линия представляет собой среднее значение, а пунктирные линии представляют 95% доверительный интервал (± 2 SD).
Рисунок 3.
Графики Бланда – Альтмана для (а) концентраций невирапина и (б) эфавиренца с использованием измеренного гематокрита и (в) концентраций невирапина и (г) эфавиренца с использованием среднего гематокрита мужчин. Непрерывная линия представляет собой среднее значение, а пунктирные линии представляют 95% доверительный интервал (± 2 SD).
Обсуждение
В этом исследовании мы продемонстрировали, что концентрации невирапина и эфавиренца в DBS показали хорошее соответствие с концентрациями в плазме после поправки на гематокрит и связывание специфических белков плазмы.
Ранее в четырех исследованиях оценивалась корреляция между концентрациями антиретровирусных препаратов в DBS и плазме. Ван Шоуневельд и др. . 16 продемонстрировал на 48 отдельных образцах пациентов, что концентрации DBS атазанавира хорошо коррелировали с концентрациями в плазме ( r 2 = 0,988), хотя концентрации DBS были немного ниже (-10,8%), чем концентрации в плазме. Коал и др. . 17 провела оценку 70 образцов пациентов (лопинавир, атазанавир, ритонавир, саквинавир и эфавиренц) на DBS и концентрации в плазме.Суммарная корреляционная кривая показала хорошую корреляцию ( r 2 = 0,9772) для всех соединений; однако концентрации DBS снова были немного ниже (-15%), чем соответствующие концентрации в плазме. Meesters и др. . 18 показали корреляцию между лопинавиром и ритонавиром в 19 DBS и образцах плазмы от детей ( r 2 = 0,8487 и 0,7679, соответственно). Однако эти образцы DBS были получены из образцов цельной крови (а не из укола пальца), и оценка систематической ошибки не проводилась.Наша группа ранее показала, что концентрации этравирина, дарунавира, ралтегравира и ритонавира в DBS были пропорциональны концентрациям в плазме, полученным из пробирок с препаратами клеток. 19 Таким образом, все предыдущие авторы сообщили, что концентрации DBS и плазмы хорошо коррелировали, хотя концентрации не были идентичными. Это исследование показало аналогичные результаты; Концентрации DBS невирапина и эфавиренца хорошо коррелировали с концентрациями в плазме, хотя концентрации DBS эфавиренца составляли 39.На 8% (стандартное отклонение 7,1%) ниже, чем концентрация в плазме. Ни один из предыдущих авторов не исследовал механизм несходства между DBS и концентрациями в плазме. Однако теперь мы показываем, что разницу в концентрациях DBS и в плазме вполне можно объяснить специфическим для соединения связыванием с белками плазмы и гематокритом с использованием адаптированной версии формулы, ранее предложенной Li и Tse. 9
Средняя разница между измеренными и теоретическими концентрациями в плазме с использованием измеренного гематокрита для невирапина и эфавиренца составила 0.29 и 0,08 мг / л соответственно. Это различие могло привести к различным клиническим решениям в 10% случаев эфавиренца (таблица 2). Однако в клинической практике эта разница может быть менее выраженной, поскольку расхождения между концентрациями, отнесенными к разным категориям, были небольшими. Например, в двух из четырех случаев все концентрации эфавиренца составляли около 1,0 мг / л (1,01, 0,68 и 0,89, 1,00 мг / л для измеренных концентраций в плазме и теоретической концентрации в плазме с учетом гематокрита для конкретного пациента, соответственно).Коррекция дозы не рекомендуется при измеренной концентрации в плазме 1,01 мг / л в соответствии с категоризацией. Однако, поскольку эта концентрация находится на границе приемлемости, в клинической практике может быть рекомендовано увеличение дозы, если у конкретного пациента вирусологически неэффективно, несмотря на соблюдение режима лечения. Таким образом, несмотря на различную категоризацию измеренных и теоретических концентраций в плазме, клиническая практика у этих пациентов может быть схожей.
Средняя разница между измеренными концентрациями в плазме и теоретическими концентрациями в плазме с использованием среднего гематокрита для мужчин (0.43 и 0,17 мг / л для невирапина и эфавиренца соответственно) была значительно выше, чем средняя разница между измеренными концентрациями в плазме и теоретическими концентрациями в плазме с использованием измеренного гематокрита ( P = 0,007 и 0,009 для невирапина и эфавиренца, соответственно). Однако не было обнаружено никакой разницы в классификации эфавиренца, что свидетельствует о том, что оба метода работают одинаково при использовании для целей TDM.
Ограничением этого исследования является то, что мы не исследовали специфическое для пациента связывание белков плазмы и связывание с эритроцитами.В среднем эфавиренц сильно связывается (99,5%) с белками плазмы, в основном с альбумином, тогда как связывание невирапина с белками плазмы составляет ~ 60%. 13 Вариабельность уровней альбумина у разных пациентов может привести к вариабельности связывания белков плазмы между пациентами, что вызывает некоторую систематическую ошибку. Однако мы исследовали уровни альбумина у всех пациентов и обнаружили, что уровень альбумина находится в пределах нормы (35–50 г / л), за исключением одного пациента (33 г / л). Таким образом, вариабельность связывания эфавиренца и невирапина с белками плазмы в этой популяции считается минимальной, что ограничивает потенциальную систематическую ошибку.Кроме того, считается, что связывание невирапина и эфавиренца с эритроцитами ограничено. Связывание невирапина и эфавиренца с эритроцитами может вызвать смещение при расчете концентраций в плазме на основе концентраций DBS. Однако мы показали, что концентрации в плазме можно адекватно предсказать по связыванию с белками плазмы и гематокриту. Это указывает на то, что предпочтительное поглощение эритроцитами было минимальным, чего можно ожидать из относительно высокого связывания обоих препаратов с белками плазмы.Еще одно ограничение заключается в том, что в нашу исследуемую популяцию в основном входили пациенты мужского пола. Поэтому для расчета концентраций в плазме мы использовали средний гематокрит мужчин. Поскольку средний гематокрит женщин и детей различается, необходимо подтверждение наших результатов в этих популяциях.
В заключение, результаты этого исследования позволяют проводить отбор проб невирапина и эфавиренца с помощью DBS для целей TDM. Теоретическая концентрация в плазме может быть рассчитана на основе концентраций DBS по формуле: [DBS [аналит] / (1 — гематокрит)] × f bpp .Так, например, для эфавиренца ( f bpp = 0,995) концентрация DBS 1,2 мг / л соответствует теоретической концентрации в плазме 2,2 мг / л {[1,2 / (1–0,45)] × 0,995}. Это открывает возможности для TDM в особых группах населения, таких как дети и беременные женщины, где ранее разрешался только ограниченный отбор проб по этическим соображениям, а также в условиях ограниченных ресурсов, где оборудование для отбора проб плазмы часто недоступно. В настоящее время продолжается оценка других антиретровирусных препаратов.
Финансирование
Работа поддержана внутренним финансированием.
Заявления о прозрачности
Не подлежат декларированию.
Благодарности
Мы хотели бы поблагодарить отделение клинической химии за помощь в наборе пациентов.
Список литературы
1ЮНЭЙДС
Глобальный отчет: Отчет ЮНЭЙДС о глобальной эпидемии СПИДа, 2010 г.
2Группа экспертов по антиретровирусным рекомендациям для взрослых и подростков, Департамент здравоохранения и социальных служб
,Руководство по использованию антиретровирусных агентов у лиц, инфицированных ВИЧ-1 Взрослые и подростки
3Европейское клиническое общество по СПИДу
,Руководство по лечению ВИЧ-инфицированных взрослых в Европе, версия 6.0, октябрь 2011 г.
4«, et al.Низкие концентрации невирапина в плазме позволяют прогнозировать вирусологическую неудачу в неотобранной популяции, инфицированной ВИЧ-1
,Clin Pharmacokinet
,2003
, vol.42
(стр.599
—605
) 5« и др.Фармакокинетические параметры невирапина и эфавиренца в зависимости от антиретровирусной эффективности
,Ретровирусы AIDS Res Hum
,2006
, vol.22
(стр.232
—9
) 6.Роль терапевтического мониторинга лекарственных средств в педиатрической борьбе с ВИЧ / СПИДом
,Ther Drug Monit
,2010
, vol.32
(стр.269
—72
) 7,,.Методы сухих пятен в терапевтическом лекарственном мониторинге: методы, анализы, подводные камни
,Ther Drug Monit
,2009
, vol.31
(стр.327
—36
) 8,.Влияние гематокрита на систематическую ошибку анализа при использовании образцов DBS для количественного биоанализа лекарственных препаратов
,Bioanalysis
,2010
, vol.2
(стр.1385
—95
) 9,.Отбор проб сухой крови в сочетании с ЖХ-МС / МС для количественного анализа малых молекул
,Biomed Chromatogr
,2010
, vol.24
(стр.49
—65
) 10,,, et al.Количественное определение ингибиторов протеаз и ненуклеозидных ингибиторов обратной транскриптазы в сухих пятнах крови методом жидкостной хроматографии и тройной квадрупольной масс-спектрометрии
,J Chromatogr B Analyt Technol Biomed Life Sci
,2008
, vol.867
(стр.205
—12
) 11,,, et al.Быстрое и одновременное определение дарунавира и одиннадцати других антиретровирусных препаратов для терапевтического мониторинга лекарственных средств: разработка и валидация метода для определения всех одобренных в настоящее время ингибиторов протеазы ВИЧ и ненуклеозидных ингибиторов обратной транскриптазы в плазме человека с помощью жидкостной хроматографии в сочетании с тандемной массой с ионизацией электрораспылением спектрометрия
,Rapid Commun Mass Spectrom
,2007
, т.21
(стр.2505
—14
) 12Институт клинических и лабораторных стандартов
,Сравнение методов и оценка смещения с использованием образцов пациентов — второе издание (промежуточная редакция): Утвержденное руководство EP09-A2-IR
,2005
Уэйн, Пенсильвания, США
CLSI
13« и др.Связывание с белками в антиретровирусной терапии
,Ретровирусы AIDS Res Hum
,2003
, vol.19
(стр.825
—35
) 14« и др.,Life: The Science of Biology
,2004
Sunderland
Sinauer Associates
15,.Статистические методы оценки соответствия двух методов клинических измерений
,Lancet
,1986
, vol.i
(стр.307
—10
) 16« и др.Клиническая оценка анализа сухих пятен крови на атазанавир
,Противомикробные агенты Chemother
,2010
, vol.54
(стр.4124
—8
) 17« и др.Количественное определение антиретровирусных препаратов в образцах сухих пятен крови с помощью жидкостной хроматографии / тандемной масс-спектрометрии
,Rapid Commun Mass Spectrom
,2005
, vol.19
(стр.2995
—3001
) 18,,, et al.Сверхбыстрый и высокопроизводительный масс-спектрометрический анализ для терапевтического лекарственного мониторинга антиретровирусных препаратов при детской ВИЧ-1-инфекции с использованием сухих пятен крови
,Anal Bioanal Chem
,2010
, vol.398
(стр.319
—28
) 19« и др.Клиническая оценка определения плазменных концентраций дарунавира, этравирина, ралтегравира и ритонавира в сухих образцах пятен крови
,Биоанализ
,2011
, vol.3
(стр.1093
—7
)© Автор, 2012. Опубликовано Oxford University Press от имени Британского общества антимикробной химиотерапии.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Плазменный поток около поверхности Солнца объясняет появление солнечных пятен и другие солнечные явления — ScienceDaily
На протяжении 400 лет люди отслеживали солнечные пятна, темные пятна, появляющиеся на поверхности Солнца в течение нескольких недель. Они наблюдали, но не смогли объяснить, почему количество пятен достигает пика каждые 11 лет.
Исследование Вашингтонского университета, опубликованное в этом месяце в журнале Physics of Plasmas , предлагает модель движения плазмы, которая объясняет 11-летний цикл солнечных пятен и некоторые другие ранее загадочные свойства Солнца.
«Наша модель полностью отличается от обычного изображения Солнца», — сказал первый автор Томас Джарбоу, профессор аэронавтики и космонавтики из Университета штата Вашингтон. «Я действительно думаю, что мы первые люди, которые рассказывают вам природу и источник солнечных магнитных явлений — как работает солнце».
Авторы создали модель на основе своей предыдущей работы по исследованию термоядерной энергии. Модель показывает, что тонкий слой под поверхностью Солнца является ключом ко многим особенностям, которые мы видим с Земли, таким как солнечные пятна, инверсия магнитного поля и солнечный поток, и подтверждается сравнениями с наблюдениями за Солнцем.
«Данные наблюдений являются ключом к подтверждению нашей картины функционирования Солнца», — сказал Джарбо.
В новой модели тонкий слой магнитного потока и плазмы, или свободно плавающих электронов, движется с разной скоростью в разных частях Солнца. Разница в скорости между потоками создает изгибы магнетизма, известные как магнитная спиральность, которые похожи на то, что происходит в некоторых концепциях термоядерных реакторов.
«Каждые 11 лет солнце увеличивает этот слой до тех пор, пока он не станет слишком большим, чтобы быть стабильным, а затем он сползает», — сказал Джарбо.Его выход обнажает нижний слой плазмы, движущийся в противоположном направлении с перевернутым магнитным полем.
Когда контуры в обоих полушариях движутся с одинаковой скоростью, появляется больше солнечных пятен. Когда контуры различаются по скорости, активность солнечных пятен снижается. Это несоответствие, говорит Джарбо, могло произойти в течение десятилетий небольшой активности солнечных пятен, известной как «минимум Маундера».
«Если два полушария вращаются с разной скоростью, тогда солнечные пятна около экватора не будут совпадать, и все это умрет», — сказал Джарбо.
«Ученые думали, что пятно образовалось на 30% глубины Солнца, а затем поднялось вверх в виде скрученной веревки плазмы, которая выскочила наружу», — сказал Джарбо. Вместо этого его модель показывает, что солнечные пятна находятся в «супергранулах», которые образуются в тонком подповерхностном слое плазмы, толщина которого, по расчетам исследования, составляет примерно от 100 до 300 миль (от 150 до 450 километров), или часть солнечной толщины в 430000 -мильный радиус.
«Солнечное пятно — удивительная вещь. Там ничего нет, а потом внезапно вы видите его в мгновение ока», — сказал Джарбо.
Предыдущее исследование группы было сосредоточено на термоядерных энергетических реакторах, в которых для отделения ядер водорода от их электронов используются очень высокие температуры, аналогичные температурам внутри Солнца. И на Солнце, и в термоядерных реакторах ядра двух атомов водорода сливаются вместе, высвобождая огромное количество энергии.
Тип реактора, на котором сосредоточился Джарбо, сферомак, содержит электронную плазму внутри сферы, которая заставляет ее самоорганизовываться в определенные структуры.Когда Джарбой начал рассматривать Солнце, он увидел сходство и создал модель того, что могло происходить с небесным телом.
«В течение 100 лет люди исследовали это, — сказал Джарбо. «Многие из наблюдаемых нами функций ниже разрешающей способности моделей, поэтому мы можем найти их только в расчетах».
Другие свойства, объясняемые теорией, по его словам, включают поток внутри Солнца, скручивающее действие, которое приводит к появлению солнечных пятен, и общую магнитную структуру Солнца.Газета, вероятно, вызовет бурную дискуссию, сказал Джарбо.
«Я надеюсь, что ученые взглянут на свои данные в новом свете, а исследователи, которые работали над сбором этих данных всю свою жизнь, получат новый инструмент, чтобы понять, что все это означает», — сказал он.
Исследование финансировалось Министерством энергетики США. Соавторами являются аспиранты UW Томас Бенедетт, Кристофер Эверсон, Кристофер Хансен, Дерек Сазерленд, Джеймс Пенна, докторанты UW Аарон Хоссак и Джон Бенджамин О’Брайан, член-корреспондент UW Брайан Нельсон и Кайл Морган, бывший аспирант UW. сейчас в CTFusion в Сиэтле.
Лизосфинголипиды из плазмы и сухих пятен крови для диагностики различных сфинголипидозов: сравнительное исследование
Фон
Лизосфинголипиды, N-деацилированные формы сфинголипидов, были идентифицированы как потенциальные биомаркеры нескольких сфинголипидозов, таких как болезни Гоше, Фабри, Краббе и Ниманна-Пика, а также ганглиозидозы GM1 и GM2. На сегодняшний день разработаны различные методы измерения различных лизосфинголипидов (LysoSL) в плазме.Здесь мы представляем новый тандемный масс-спектрометрический анализ с жидкостной хроматографией (LC-MS / MS) для одновременного количественного определения LysoSL (HexSph, LysoGb3, LysoGM1, LysoGM2, LysoSM и LysoSM509) в сухих пятнах крови (DBS). Этот метод LC-MS / MS использовался для сравнения уровней LysoSL в DBS и плазме как у пораженных пациентов, так и у здоровых людей из контрольной группы.
Методы
Лизосфинголипиды экстрагировали из DBS диаметром 3,2 мм смесью метанол: ацетонитрил: вода (80: 15: 5, об. / Об.), Содержащей внутренние стандарты стабильных изотопов.Хроматографическое разделение выполняли с использованием колонки C18 с градиентом воды и ацетонитрила, оба с 0,1% муравьиной кислотой, за общее время анализа 4 мин. Соединения детектировали в режиме ионизации электрораспылением положительных ионов (ESI) -MS / MS с помощью мониторинга множественных реакций (MRM).
Результаты
Метод был проверен на DBS для демонстрации специфичности, линейности, нижнего предела количественного определения, точности и прецизионности. Референсные диапазоны были определены в педиатрической и взрослой популяции.Повышенные уровни LysoSL были идентифицированы при болезни Гоше (HexSph), болезни Фабри (LysoGb3), дефиците просапозина (HexSph и LysoGb3) и типах болезни Ниманна-Пика A / B и C (LysoSM и LysoSM509). Корреляция уровней между DBS и плазмой была превосходной для LysoGb3 и HexSph, но плохой для LysoSM и LysoSM509.
Выводы
Несмотря на то, что определение LysoSL в плазме остается золотым стандартом, наш метод LC-MS / MS позволяет быстро и надежно определять количество лизосфинголипидов в DBS.Этот метод является полезным инструментом для диагностики различных сфинголипидозов, за исключением типа C.
Ниманна-Пика.Введение
Лизосомные нарушения накопления (LSD) — это группа из 50 унаследованных врожденных нарушений метаболизма, характеризующихся дефицитом лизосомального фермента. Эти ЛСД обладают широким спектром фенотипов, что может привести к задержке постановки диагноза. При некоторых заболеваниях отсрочка диагностической процедуры может отрицательно повлиять на эффективность лечения, например, заместительной ферментной терапии, сокращения субстрата или трансплантации костного мозга.Для большинства этих LSD измерение специфической активности ферментов в лейкоцитах (лейкоцитах и лимфоцитах) считается золотым стандартом диагностики этих расстройств. В 2001 году Chamoles et al. впервые представили использование пятен цельной сухой крови (DBS) для определения ферментативной активности нескольких LSD [1] с использованием флуоресценции 4-метилумбеллиферона в качестве субстрата. Впоследствии использование DBS для ферментативного определения было предложено в качестве альтернативы быстрой диагностике LSD.DBS предлагает особые преимущества перед использованием обычных образцов, такие как простота взятия, небольшой объем крови, условия хранения и транспортировки (комнатная температура) [2]. Ферментативная активность в DBS была недавно измерена тандемной масс-спектрометрией (MS / MS) [3], [4]. Универсальность МС / МС позволила применять этот метод не только для ферментативного определения, но и для обнаружения биомаркеров [5]. В этом контексте лизосфинголипиды (LysoSLs), N-деацилированные формы сфинголипидов, были идентифицированы как потенциальные биомаркеры нескольких LSD, в частности сфинголипидозов, таких как болезнь Гоше (GD), болезнь Фабри (FD), болезнь Краббе (KD). и болезни Ниманна-Пика типа A / B (NPA / B) и типа C (NPC), а также ганглиозидозы GM1 и GM2.Ряд исследований показал использование измерения LysoSL либо в плазме, либо в DBS: лизоглоботриаозилцерамид (Lyso-Gb3) для FD [6], [7], [8], [9], [10], галактозилсфингозин (GalSph, также называемый психозином) для KD [11], [12], [13], глюкозилсфингозин (GlcSph) для GD [14], [15], [16], [17], лизосфингомиелин (LysoSM) для NPA / B [18 ], [19] и лизосфингомиелин 509 (LysoSM509) для NPC и NPAB [19].
Мы недавно описали метод тандемной масс-спектрометрии с быстрой жидкостной хроматографией (LC-MS / MS) для одновременного количественного определения в плазме HexSph (GalSph + GlcSph), LysoGb3 и LysoSM, включая LysoSM509 [20].Другие исследования подтвердили полезность мультиплексного анализа LysoSL в плазме как надежного инструмента для диагностики сфинголипидозов [21], [22], [23].
Мы разработали и утвердили новый тест для одновременного определения LysoSL в DBS с помощью MS / MS. Концентрацию LysoSL определяли у здоровых людей и у пациентов, страдающих следующими сфинголипидозами: болезни Фабри, Гоше, Краббе, Ниманна-Пика типов A, B и C, дефицит просапозина и ганглиозидозы GM1 и GM2.Мы также выполнили измерение LysoSL в DBS новорожденных, выявленных неонатальным скринингом, чтобы оценить интерес этих биомаркеров для теста второго уровня некоторых лизосомных заболеваний.
Материалы и методы
Химия и реактивы
Ацетонитрил и метанол для ЖХ-МС и ДМСО для высокоэффективной жидкостной хроматографии (ВЭЖХ) были приобретены у Sigma Aldrich (Сент-Луис, Миссури, США). Муравьиная кислота для UPLC-MS (чистота> 99%) была предоставлена Biosolve-Chemicals (Dieuze, Франция).Сверхчистая вода была получена с использованием системы Milli-Q (Millipore, Бедфорд, Массачусетс, США). Стандарты липидов 1- бета, -D-глюкозилсфингозин (GlcSph), лизо, -глоботриаозилсфингозин (LysoGb3), лизо, -сфингомиелин (LysoSM) и lyso, -Sphingomyelin (LysoSM) и lyso, -Monosialoganglioside, 1 LLC (Государственный колледж, Пенсильвания, США). Глюкозил (b) сфингозин-d5 (GlcSph-d5) и лизо -сфингомиелин-d7 (LysoSM-d7) были приобретены у Avanti Polar Lipids, а lyso -Monosialoganglioside GM 2 Inc. (LysoGaraM2) у LysoGaraM2).(Сига, Япония).
Образцы пациентов
Образцы DBS были получены от пациентов, направленных в отделение наследственных метаболических заболеваний Университетской больницы Падуи. В когорту вошли 114 педиатрических и взрослых пациентов (средний возраст 37 лет, диапазон 0–77 лет) с БГ типа 1 (n = 25), БГ типа 3 (n = 1), БФ (n = 36 мужчин, n = 25 женщин). ), KD (n = 2), болезни Ниманна-Пика типа A / B (NPA / B, n = 6), тип Ниманна-Пика C (NPC, n = 4, все NPC1), GM1 (n = 1) и GM2 (n = 2) ганглиозидозы и дефицит просапозина (PSAPD, n = 2).За исключением пяти пациентов с GD, у которых биомаркеры LysoSL были определены в DBS новорожденных, все остальные DBS были собраны во время клинического мониторинга. У всех пациентов был подтвержденный диагноз, основанный на ферментативном и молекулярном анализе. Чтобы установить нормальные референсные значения для каждого биомаркера, контрольные образцы были взяты у 253 анонимных здоровых взрослых доноров крови (n = 133) и педиатрических пациентов (n = 120) с диапазоном сбора от 0 до 79.
DBS собирали с использованием стандартных процедур, прокалывая кончик пальца ланцетом и собирая цельную кровь.Кровь капали на карту для сбора образцов 903 (GE Healthcare, Кардифф, Великобритания), которую сушили на воздухе в течение примерно 2 часов. Образцы, собранные в виде цельной крови с ЭДТА, наносились на фильтровальную бумагу в нашей лаборатории с использованием 50 мкл цельной крови.
Образцы крови, использованные для сравнения плазмы с методом DBS, были собраны у здоровых людей с подтвержденным LSD (n = 306). У каждого человека кровь собирали в пробирку с ЭДТА, и 50 мкл цельной крови наносили на фильтровальную бумагу.Оставшуюся кровь центрифугировали в течение 10 мин при 2000 g , и плазму хранили при -80 ° C. Все DBS впоследствии хранили при -20 ° C в пластиковых пакетах с застежкой-молнией, содержащих осушитель. Этическое одобрение было получено от этического комитета больницы Падуи. Концентрации LysoSL в плазме измеряли с помощью ЖХ-МС / МС с использованием недавно описанного метода [20].
Подготовка калибровочных стандартов DBS и контроля качества (QC)
Исходные стандартные растворы и рабочие растворы для всех аналитов готовили гравиметрически, как описано ранее Polo et al.[20]. GlcSph использовали в качестве стандарта HexSph для калибровочной кривой и контроля качества. Исходные стандартные растворы LysoGM1 и LysoGM2 были приготовлены по весу с конечной концентрацией 0,1 мг / мл. Экстракционный раствор с внутренними стандартами готовили разбавлением в растворе метанол: ацетонитрил: вода (80/15/5, об / об / об) с LysoSM-d7 и GlcSph-d5 при 2,5 нмоль / л и хранили при -80. ° C перед использованием.
Калибровочную кривую с восемью уровнями получали путем добавления чистых стандартов объединенной человеческой кровью перед нанесением пятен (диапазон: 0–100 нмоль / л для LysoGb3, LysoGM1 и LysoGM2; 0–1000 нмоль / л для LysoSM и HexSph).Для измерения LysoSM-509 мы приняли относительное отношение ответа к LysoSM, равное 1 (обратите внимание, что коммерческий стандарт еще не доступен). Прецизионность и точность анализа оценивали с использованием контрольных образцов для трех уровней концентрации, которые были приготовлены из объединенной крови с ЭДТА. Для LysoGb3, LysoGM1 и LysoGM2 использовали эндогенный QC1, эндогенный QC2 + 8 нмоль / л и эндогенный QC3 + 80 нмоль / л. Для LysoSM и HexSph использовали эндогенный QC1, эндогенный QC2 + 80 нмоль / л и эндогенный QC3 + 800 нмоль / л.Затем около 50 мкл крови с добавлением капель наносили на карту для сбора образцов 903, сушили при комнатной температуре и хранили при -20 ° C до анализа.
Пробоподготовка
Для экстракции лизосфинголипидов из DBS в 96-луночный микропланшет вставляли диск диаметром 3,2 мм и добавляли 100 мкл экстракционного раствора. Микропланшет инкубировали 1 ч при 45 ° C с орбитальным встряхиванием (500 об / мин). После инкубации добавляли 50 мкл воды Milli-Q и разбавленную экстрагированную смесь переносили в новый микропланшет.Затем 8 мкл вводили в систему ЖХ-МС / МС.
ЖХ-МС / МС
Измерения лизосфинголипидов проводили методом обращенно-фазовой жидкостной хроматографии с использованием Waters Acquity UPLC и колонки BEH C18 2,1 × 50 мм с размером частиц 1,7 мкм (Waters, США). Масс-спектрометрическое детектирование проводили с помощью микродетектора Xevo TQs (Waters, США), установленного в положительный режим, с использованием источника ионизации электрораспылением (ESI). Анализ ЖХ-МС / МС выполняли, как описано ранее [20], с включением переходов для мониторинга множественных реакций (MRM) GlcSph-d5, LysoSM-d7, LysoGM1 и LysoGM2.Два перехода MRM, выбранные для LysoGM1 и LysoGM2, были 1118,73–204,06 m / z и 1280,65–204,07 m / z с CE 40 V и CE 56 V, соответственно. CV было 30 В для обоих. Все параметры были оптимизированы путем прямого введения стандартных растворов в масс-спектрометрию для получения лучшего сигнала.
Проверка метода
Точность метода оценивалась путем проведения исследований по извлечению с использованием КК. Точность выражалась в процентах относительной ошибки (% RE) и рассчитывалась путем вычитания номинального уровня из среднего значения, деленного на теоретическое количество, а затем умноженного на 100: ([среднее – номинальное] / [номинальное] × 100).Прецизионность внутри цикла и между прогонами определялась путем подготовки и анализа каждого QC 10 раз за цикл в течение 10 последовательных рабочих дней. Предел обнаружения (LOD) для каждого биомаркера был определен с использованием отношения сигнал / шум, равного 3. Пики с отношением сигнал / шум более 10 были приняты и интегрированы (нижний предел количественной оценки).
Анализ данных
Статистический анализ выполняли с использованием программного обеспечения GraphPad Prism (GraphPad Software Inc., Сан-Диего, Калифорния, США) и MedCalc.Контрольные значения LysoSL были выражены как медиана и 2,5–97,5 процентилей распределений. Значения LysoSL для пациентов, затронутых LSD, были выражены как медиана с минимальными / максимальными значениями из-за небольшого количества образцов для каждого заболевания. Для сравнения методов плазмы и DBS использовались процедура регрессии Деминга и анализ Бланда-Альтмана.
Результаты
Проверка метода DBS
Стандарты LysoGb3, LysoSM, HexSph (GalSph + GlcSph), LysoGM1 и LysoGM2 были легко обнаружены с помощью МС / МС (дополнительный материал, рис. 1).Дейтерированные внутренние стандарты LysoSM (LysoSM-d7) и GlcSph (GlcSph-d5) использовали вместо GlcSph из растений для корректировки эффективности экстракции и любых матричных эффектов (таблица 1). Исследования линейности, нижний предел обнаружения и предел количественного определения приведены в таблице 2. Коэффициенты корреляции (R 2 ) были приемлемыми на уровне 0,995, за исключением коэффициентов для LysoGM1 и LysoGM2, превышающих 0,97. Высшая точка калибровочной кривой (высокое RSD) была исключена. Для обоих аналитов DBS дал более низкую линейность, чем то, что было получено для плазмы или водных растворов.Эндогенные уровни LysoGb3, HexSph и LysoSM были рассчитаны из концентраций пересечения по оси y для нескольких калибровочных кривых (n = 3), за исключением уровней LysoGM1 и LysoGM2, которые не определялись в объединенной цельной крови.
Таблица 1:параметров MRM для количественного определения LysoSL и соответствующего внутреннего стандарта.
| Лизосфинголипиды | Родитель, м / з | Дочь, м / з | Напряжение конуса, В | Энергия столкновения, В | Время удерживания, мин | Внутренний стандарт |
|---|---|---|---|---|---|---|
| LysoGb3 | 786.5 | 282,3 | 20 | 35 | 1,69 | GlcSph-d5 |
| HexSph | 462,3 | 282,3 | 30 | 20 | 1,90 | GlcSph-d5 |
| GlcSph-d5 | 467,3 | 287,3 | 30 | 20 | 1.89 | – |
| ЛизоСМ | 465,4 | 184,1 | 30 | 22 | 1,74 | ЛизоСМ-d7 |
| ЛизоСМ-d7 | 472,5 | 184,1 | 30 | 22 | 1,73 | – |
| ЛизоСМ-509 | 509.0 | 184,1 | 30 | 22 | 2,52 | ЛизоСМ-d7 |
| LysoGM1 | 1280,6 | 204,1 | 20 | 56 | 1,86 | GlcSph-d5 |
| LysoGM2 | 1118,6 | 204,1 | 20 | 45 | 1.92 | GlcSph-d5 |
Данные валидации LysoSL: диапазон измерения и линейность.
| Линейность, R 2 (n = 3) | LLOD, нмоль / л | LLOQ, нмоль / л | Верхний предел линейности | |
|---|---|---|---|---|
| LysoGb3 | 0.995 | 0,26 | 0,45 | 197 |
| ЛизоСМ | 0,994 | 5,15 | 10,31 | 2121 |
| HexSph | 0,996 | 0,81 | 1,62 | 1965 |
| LysoGM1 | 0,979 | 2,50 | 5 | 105.1 |
| LysoGM2 | 0,975 | 1,25 | 2,5 | 106,9 |
Внутрианалитическая точность LysoGb3, LysoSM и HexSph была лучше 10% на всех уровнях. Как для LysoGM1, так и для LysoGM2 точность внутри анализа превышала 15% и 20% соответственно (таблица 3). Прецизионность между анализами была ниже 20% для всех аналитов, кроме LysoGM1 и LysoGM2 (средний уровень: 33,2% и 24.4% соответственно). Перенос определяли, вводя холостой образец после наивысшего калибровочного стандарта и находя его незначительным.
Таблица 3:Аналитические характеристики метода ЖХ-МС / МС: суточная и межсуточная точность (процентный коэффициент вариации) при трех уровнях концентрации и точность (относительная погрешность в процентах).
| QC1 (низкий) | QC2 (средний) | QC3 (высокий) | ||||||
|---|---|---|---|---|---|---|---|---|
| Среднее ± SD, нмоль / л | Точность, CV% | Среднее ± SD, нмоль / л | Точность, CV% | Точность, RE% | Среднее ± SD, нмоль / л | Точность, CV% | Точность, RE% | |
| Внутрианализ (n = 15) | ||||||||
| LysoGb3 | 1.74 ± 0,17 | 9,5 | 9,0 ± 0,7 | 7,7 | 90,7 | 62,2 ± 4,4 | 7,1 | 75,6 |
| ЛизоСМ | 157,8 ± 9,3 | 5,9 | 247,7 ± 16,9 | 6,8 | 112,5 | 1042,3 ± 66,7 | 6,4 | 110,6 |
| HexSph | 20.2 ± 0,9 | 4,6 | 112,5 ± 8,5 | 7,6 | 115,4 | 889,9 ± 57,0 | 6,4 | 108,7 |
| LysoGM1 | ND | 7,8 ± 0,9 | 11,4 | 97,7 | 73,8 ± 11,5 | 15,5 | 92,3 | |
| LysoGM2 | ND | 8.4 ± 0,8 | 10,0 | 104,7 | 95,6 ± 6,9 | 7,2 | 119,5 | |
| Между анализами (n = 15) | ||||||||
| LysoGb3 | 1,70 ± 0,25 | 14,6 | 10,2 ± 1,4 | 13,8 | 106,1 | 65,5 ± 8,70 | 13,3 | 79,8 |
| ЛизоСМ | 163.4 ± 17,6 | 10,8 | 252,0 ± 35,6 | 14,1 | 110,8 | 990,0 ± 104,0 | 10,6 | 103,3 |
| HexSph | 20,5 ± 2,4 | 11,8 | 108,3 ± 10,1 | 9,3 | 109,8 | 850,2 ± 69,6 | 8,2 | 103,7 |
| LysoGM1 | ND | 7.1 ± 2,3 | 33,2 | 85,5 | 86,4 ± 13,3 | 15,4 | 108,0 | |
| LysoGM2 | ND | 6,5 ± 1,6 | 24,4 | 81,3 | 89,6 ± 16,8 | 18,7 | 112,0 | |
Лизосфинголипиды в образцах DBS
В таблице 3 представлены уровни DBS LysoGb3, HexSph, LysoSM, LysoSM509, LysoGM1 и LysoGM2 в контроле и у пациентов с LSD.
В неповрежденном контроле концентрации метаболитов LysoGb3, HexSph, LysoSM и LysoSM509 были низкими, но в пределах определяемого методом предела, а концентрации LysoGM1 и LysoGM2 не определялись. Никаких измеримых различий в уровнях этих метаболитов в зависимости от пола или возраста обнаружено не было.
Метод мультиплексирования MS / MS был применен для определения уровней LysoSL у 114 пациентов, затронутых LSD (Таблица 3 и Рисунок 1). Уровни LysoSL, идентифицированные при каждом сфинголипидозе, имели специфический характер.
Рисунок 1:
LysoSLs в контрольной группе здоровых людей (CTRL) и у пациентов со сфинголипидозами.
LysoGb3 (A), HexSph (B), LysoSM (C) и LysoSM509 (D). Данные по здоровым пациентам представлены в виде 25–75-го процентиля (усы: 2,5-й и 97,5-й), а для пораженных пациентов — в виде диаграмм разброса. Горизонтальные линии обозначают медианное значение распределения. Горизонтальные пунктирные линии представляют 97,5-й процентиль здорового населения.Все графики представлены в логарифмической шкале 10 .
LysoGb3 был увеличен у всех пациентов с БФ. Уровни были выше у мужчин с классической формой заболевания и были на промежуточном уровне у мужчин с поздним началом и у женщин (рис. 1A). LysoGb3 также был повышен, хотя и незначительно, при GD и у двух пациентов с дефицитом просапозина.
Наблюдалось 17-кратное повышение HexSph в DBS у пациентов с GD vs.элементы управления (рис. 1B). Анализ неонатального DBS у 5 пациентов с GD, выявленных при скрининге новорожденных, выявил значительное повышение HexSph (среднее значение: 113,0 нмоль / л, диапазон: 92–163,8 нмоль / л, здоровый контроль 2,3–31,1 нмоль / л) (дополнительный материал, Таблица S1). При KD HexSph был умеренно повышен у одного пациента с ранней KD, но не у других бессимптомных пациентов KD (образец, собранный на пятый день жизни у братьев и сестер инфантильного пациента KD).
LysoSM был явно увеличен у пациентов с NPA / B в 10 раз (рис. 1C).Значительное, но менее выраженное увеличение наблюдалось у пациентов с NPC (p = 0,002) и GD (p <0,0001), у которых уровни прогрессивно снижались по сравнению с пациентами NPA / B. LysoSM509 показал аналогичную картину с очень высокими значениями NPA / B и перекрывающимися значениями с верхним диапазоном незатронутых контролей в NPC и GD (рис. 1D). LysoGM1 и LysoGM2 были ниже LOD в контроле и у пациентов, страдающих сфинголипидозами, отличными от ганглиозидозов GM1 и GM2 (рис. 2).LysoGM1 был повышен у пациента с инфантильным ганглиозидозом GM1. LysoGM2 был обнаружен у одного пациента с инфантильной болезнью Сандхоффа, но не у взрослого пациента Сандхоффа (таблица 3).
Рисунок 2:
Хроматограммы LysoGM1 (A, B) и LysoGM2 (C, D).
MRM переходы LysoGM1 и LysoGM2 при ганглиозидозе GM1 (A) и ганглиозидозе GM2 (C) соответственно. Никаких сигналов не обнаружено у здоровых контролей (B для LysoGM1, D для LysoGM2).S / N, отношение сигнал / шум; RMS, среднеквадратичное значение.
Сравнение плазмы и DBS
Уровни LysoGb3, GlcSPh, LysoSM и LysoSM509 сравнивали среди типов матрикса образцов, DBS и плазмы в сопоставленных образцах здорового контроля и положительных пациентов (рис. 3).
Рисунок 3:
Сравнение уровней LysoGb3 (A, B), HexSph (GlcSph) (C, D), LysoSM (E, F) и LysoSM509 (G, H) в DBS и плазме.
Результаты, полученные для обеих матриц, количественно сравнивали с использованием регрессии Деминга (слева) (y = результаты DBS; x = результаты плазмы; нмоль / л). Для LysoSM (E) и LysoSM509 (G) данные полного диапазона отображаются на полноразмерном рисунке, а нижние точки данных (для LysoSM, 0–100 нмоль / л в плазме; для LysoSM509, 0–1000 нмоль / л в плазме) отображаются в виде вставки на графике. Показаны найденный наклон, точка пересечения по оси y и коэффициент Пирсона r (r). Смещение было проанализировано с использованием графика Бланда-Альтмана (справа), на котором по оси Y отложено значение ([DBS-Plasma] / среднее)% vs.среднее значение двух методов.
Линейная корреляция наблюдалась между LysoGb3 в плазме и DBS в 298 случаях (y = 0,35 + 0,945 ×, n = 298, r 2 0,977). График, приведенный на рисунке 3B, показывает отсутствие смещения между двумя типами матриц.
Для HexSph наблюдалась хорошая линейная корреляция (уравнение y = 16,5354 + 2,7070 ×, n = 307, r 2 0,970) между двумя типами матриц. Существенная разница наблюдалась между двумя типами матриц, определяемыми наклоном (2.7) корреляции, причем уровни в DBS были выше, чем в плазме, со средним смещением 134% (95% ДИ 42,5–225,6) (рис. 3D).
Сравнение плазмы и DBS показало плохой результат корреляции для LysoSM в полном диапазоне концентраций (0–856 нмоль / л в плазме, r 2 0,816). Корреляция между значениями наблюдалась при уровнях более 50 нмоль / л в плазме. Средние концентрации были выше в DBS, чем в плазме при значениях ниже 50 нмоль / л в плазме, а уровни DBS были выше, чем в плазме при значениях выше 50 нмоль / л.
Аналогичная картина наблюдалась в LysoSM509 с r Пирсона 0,5989 (n = 264) для всего диапазона концентраций (0–10 000 нмоль / л в плазме). Не было обнаружено корреляции для данных в 0-800 нмоль / л в плазме (r Пирсона = -0,11; n = 241), а r Пирсона составляло 0,84 для значений выше 800 нмоль / л в плазме.
Мы сравнили способность уровней LysoSL идентифицировать пораженных пациентов как в матриксе DBS, так и в плазме (рис. 4). Кривая сравнения рабочих характеристик приемника (ROC) использовалась для LysoGb3 (Рисунок 4A) и HexSph (Рисунок 4B) с использованием парных образцов плазмы и DBS от пациентов, страдающих болезнью FD и GD, соответственно, а затем нанесена на график в зависимости от незатронутые или другие сфинголипидозы.Как правило, две матрицы показали отличные характеристики с AUC, близкой к 1, но для обоих LysoSL AUC была немного выше в плазме, чем в DBS.
Рисунок 4:
ROC-анализ: сравнение плазмы (красный) и DBS (синий) для LysoGb3 (A) и HexSph (B) для болезней Фабри и Гоше, соответственно, по сравнению со здоровой контрольной группой.
AUC, площадь под кривой; 95% ДИ, 95% доверительный интервал.
Сравнение LysoSM и LysoSM509 в двух матрицах было ограничено из-за количества доступных пациентов, пораженных NPA / B и NPC, и возможности графического отображения данных (рис. 5). В плазме одновременное определение LysoSM и LysoSM509 позволило четко отличить NPA / B от NPC и в неповрежденном контроле (рис. 5A). В DBS это разделение было менее выраженным, и только пациенты NPA / B показали увеличение LysoSM и LysoSM509.В NPC уровни обоих аналитов были около 95-го процентиля здоровой популяции (рис. 5А).
Рисунок 5:
Уровни LysoSM и LysoSM509 (нмоль / л) у пациентов с NPA / B и NPC, измеренные в DBS (A) и в плазме (B).
Прекращенные линии указывают предел контрольных значений (97,5 процентиль).
Обсуждение
Недавно было идентифицировано несколько биохимических маркеров, которые могут помочь в диагностике нескольких сфинголипидозов.Мы сообщили о чувствительном мультиплексном методе измерения различных лизосфинголипидов в плазме для диагностики заболеваний Фабри, Гоше, Краббе, Ниманна-Пика типа A, B и C и дефицита просапозина [20], [24]. Подобные исследования были выполнены другими группами [5], [21], [22], [23]. Несмотря на различные аналитические подходы с точки зрения подготовки образцов, внутреннего стандарта и анализа ЖХ-МС / МС, все эти исследования подтвердили, что одновременное количественное определение LysoSL может быть полезным тестом первого уровня для скрининга пациентов с подозрением на сфинголипидозы.
В этом исследовании мы расширили возможности одновременного определения и количественно измерили уровни LysoSL в двух типах матриц образцов, DBS и плазме, используя дейтерированные формы LysoSM и GlcSph в качестве внутреннего стандарта. Мы также включили LysoGM1 и LysoGM2 в панель для обнаружения ганглиозидозов GM1 и GM2 соответственно. Сравнение плазмы с DBS дало несколько преимуществ, а именно: относительно неинвазивный отбор образцов, низкую стоимость сбора образцов и минимальные требования к предварительной обработке для обработки и транспортировки образцов.
Кроме того, количественная оценка уровней LysoSL была выполнена с помощью ультра — (U) HPLC-MS / MS из небольшого объема образца, пробойника 3 мм (≈3,2 мкл крови), что обеспечило хорошие аналитические характеристики. для LysoGb3, LysoSM и HexSph с точки зрения точности, точности и линейности. Аналитические характеристики между анализами и внутри анализов были приемлемыми и хорошо воспроизводимыми с коэффициентом вариации менее 10% (Таблица 3). LysoGM1 и LysoGM2 продемонстрировали низкую эффективность ионизации с помощью МС / МС с самым высоким отношением сигнал / шум, достигнутым в положительном режиме.Для этих двух аналитов наблюдались некоторые количественные ограничения, обнаруженные в других исследованиях, проведенных в плазме [21]. Концентрации были представлены как приблизительные оценки (таблица 4) отчасти из-за отсутствия подходящего стандарта, меченного изотопами [19].
Таблица 4:DBS концентрации LysoGb3, HexSph, LysoSM, LysoSM509, LysoGM1 и LysoGM2 в контроле и у пациентов с LSD (медиана, диапазон).
| n | Средний возраст, лет (диапазон) | LysoGb3, нмоль / л | HexSph, нмоль / л | ЛизоСМ, нмоль / л | LysoSM509 c , нмоль / л | LysoGM1 b , нмоль / л | LysoGM2 b , нмоль / л | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Медиана | Диапазон | Медиана | Диапазон | Медиана | Диапазон | Медиана | Диапазон | Медиана | Диапазон | Медиана | Диапазон | |||
| Элементы управления | 253 | 18 (0.1–79) | 0,5 | ND – 1.45 а | 14,5 | 2,3–31,1 а | 52,4 | 6,6–112,8 а | 894 | 105–5548 а | <2,5 | н.у. | <1,25 | н.г. |
| Болезнь Фабри всего | 71 | 49 (4–77) | 8.7 | 1,7–231,8 | 17,3 | 1 | 81,6 | 15,5–193,7 | 1516 | 268–5931 | <2,5 | н.г. | <1,25 | н.г. |
| Самец, классический фенотип | 24 | 49 (13–60) | 38,4 | 6,0–231,8 | 18.2 | 7,4–49,6 | 88,2 | 15,5–150,5 | 1719 | 704–5931 | <2,5 | н.г. | <1,25 | н.г. |
| Самец, атипичный фенотип | 12 | 48 (4–77) | 7,0 | 2,7–35,5 | 19,4 | 9,3–31,5 | 109.3 | 92,9–154,3 | 1899 | 752–2741 | <2,5 | н.г. | <1,25 | н.г. |
| Женский | 25 | 48,5 (15–70) | 8,3 | 1,7–34,4 | 16,4 | 4,6–34,2 | 65,5 | 20,6–193,7 | 1501 | 269–5382 | <2.5 | н.г. | <1,25 | н.г. |
| Болезнь Гоше | 26 | 24 (0,0–65) | 1,2 | 0,5–3,5 | 252,7 | 61,7–2660 | 77,9 | 43,3–154,6 | 1030 | 386–5928 | <2,5 | н.г. | <1,25 | п.грамм. |
| Болезнь Краббе | 2 | 0,3 (0,0–0,6) | 1 | 0,5–1,4 | 81,8 | 25,9–137,8 | 50,8 | 38,9–62,7 | 682 | 602–763 | <2,5 | н.г. | <1,25 | н.г. |
| Болезнь Ниманна-Пика A / B | 6 | 40.5 (2–57) | 0,6 | 0–1,7 | 11,4 | 0,5–16,1 | 628,8 | 244,4–1993 | 14 212 | 5943–46 555 | <2,5 | н.г. | <1,25 | н.г. |
| Болезнь Ниманна-Пика C | 4 | 39 (7–68) | 1,4 | 0.2–2,3 | 15,5 | 13–20,3 | 115,0 | 82,7–141,8 | 5382 | 4082–6085 | <2,5 | н.г. | <1,25 | н.г. |
| Ганглиозидоз GM1 | 1 | 0,6 | 0,2 | – | 34,7 | – | 68.5 | – | 489 | – | 58 | н.г. | <1,25 | н.г. |
| Ганглиозидоз GM2 (Sandhoff) | 2 | 32 (2–62) | 1 | 0,9–1 | 24,9 | 8,9–40,9 | 131,3 | 89,2–173,5 | 6813 | 2118–11 508 | <2.5 | н.г. | 15,25 | 1,31–29,2 |
| Недостаток просапозина | 2 | 0,2 (0,1–0,3) | 6,5 | 5–8 | 164,4 | 116,3–212,4 | 34,9 | 29,7–40,1 | 3452 | 3284–3620 | <2,5 | н.г. | <1.25 | н.г. |
В этом исследовании мы количественно оценили уровни LysoSL в большой когорте DBS, собранных у здоровых контролей (n = 253) и у пациентов, затронутых сфинголипидозами (n = 114). В целом, DBS могут четко отличать контроль от положительных пациентов, что согласуется с исследованиями, в которых использовалась плазма [20], [21]. Мы также сравнили LysoSL (LysoGb3, HexSph, LysoSM и LysoSM509) в плазме и DBS, чтобы определить способность идентифицировать пораженных пациентов между двумя типами матрикса.
LysoGb3 в DBS изучали на большой когорте пациентов Fabry (n = 71), состоящей из пораженных мужчин с классическим фенотипом и фенотипом с поздним началом, а также женщин. Мы наблюдали высокий уровень LysoGb3 у мужчин с классическим фенотипом и от легкого до умеренного повышения у обоих мужчин с поздним началом и гетерозиготных женщин. Как показали предыдущие исследования, нормальный LysoGb3 не может исключить болезнь Фабри у женщин, но очень маловероятно может поставить диагноз FD у мужчин [25], [26]. Количество сэмплов в 3.Пятно крови размером 2 мм было примерно в 50 раз меньше, чем обычно используется в плазме, и как чувствительность, так и специфичность тестирования LysoGb3 на DBS были лишь незначительно снижены по сравнению с таковыми в плазме (AUC DBS 0,9671 против AUC плазмы 0,9754) .
HexSph в DBS пациентов с GD был сильно повышен и согласуется с предыдущими исследованиями плазмы [14], [20]. Чувствительность HexSph к GD в DBS была весьма удовлетворительной и лишь незначительно ниже, чем в плазме (AUC DBS 0.9883 против AUC плазмы 0,9966). У этих пациентов также наблюдалось небольшое повышение уровня LysoGb3 [20], [21], [23].
Сообщалось, чтоHexSph умеренно повышен в плазме и DBS в случаях инфантильной KD [11], [12], [20]. В этом исследовании LysoSL были протестированы только на двух пациентах с KD, и только у одного пациента с симптоматической формой раннего младенчества был высокий уровень HexSph.
Два пациента с дефицитом PSAP (крайне редкое заболевание), ранее диагностированным с помощью тестирования LysoSL в плазме [24], показали повышенные уровни LysoGb3 и HexSph в DBS.На сегодняшний день дозировка LysoSL является единственным доступным биохимическим тестом для выявления дефектов сапозина, как дефицита сапозина C, так и дефицита просапозина [21], [24].
С помощью нашего метода концентрации LysoGb3 в плазме и DBS сильно коррелировали и позволяли идентифицировать пораженных пациентов [27]. Подобно LysoGb3, для HexSph наблюдалась сильная корреляция между плазмой и DBS. Для этого метаболита концентрацию в плазме можно оценить по DBS с использованием коэффициента пересчета 2.7. Не наблюдалось смещения между плазмой и пятном высушенной плазмы (данные не показаны), и это можно объяснить различным распределением HexSph среди компонентов крови (плазма и эритроциты).
LysoGM1 и LysoGM2 были предложены в качестве биомаркеров двух других крайне редких лизосомных заболеваний, ганглиозидозов GM1 и GM2. Сообщается, что чувствительность этих маркеров в плазме является низкой и критической для более поздних форм [5], [21]. Мы проанализировали эти маркеры у ограниченного числа пациентов (GM1 n = 1; GM2 n = 2).И плазма, и DBS давали нормальный LysoGM2 для пациентов с поздней формой GM2, называемой болезнью Сандхоффа [28]. Инфантильные формы GM1 и GM2 были правильно идентифицированы в DBS.
Повышение плазменных уровней как LysoSM, так и LysoSM509 в плазме является отличительным признаком заболеваний NPA / B и NPC [19], [29], [30]. Комбинированное определение этих метаболитов в плазме позволило различить два расстройства [5], [31]. В DBS от пациентов с NPB было обнаружено, что LysoSM повышен примерно в пять раз и не перекрывается с нормальным контролем, что делает его потенциально полезным биомаркером [18].Более ранние исследования показали, что анализы LysoSM и LysoSM509 в образцах DBS хуже, чем измерения в плазме, и должны выполняться только в тех случаях, когда DBS является единственным доступным материалом [31]. Наши данные, даже если они были получены в ограниченном количестве образцов, показали снижение чувствительности DBS для обнаружения NPC, особенно в тех случаях, когда значения DBS находятся в верхнем диапазоне для здоровых популяций. Исследования корреляции для LysoSM и LysoSM509 между плазмой и DBS также подчеркнули отсутствие коммутируемости между двумя матрицами.Как сообщается в двух различных исследованиях, наиболее надежными биомаркерами для диагностики NPC в DBS являются желчная кислота 3β, 5α, 6β-тригидроксихолановая кислота и ее конъюгат с глицином [32], [33].
ИзмеренияHexSPh и LysoGb3 были предложены в качестве биомаркеров для мониторинга заместительной ферментной терапии (ФЗТ) при ФД и ГД соответственно [14], [15], [34], [35]. Для GD стал доступен новый пероральный препарат, что снизило количество посещений больницы [36], [37]. DBS может быть полезен для домашнего наблюдения за этими пациентами.Кроме того, пациенты могли взять образец крови простым пальцем и отправить DBS в лабораторию для анализа, как и в случае других наследственных метаболических заболеваний (например, PKU). Для облегчения клинической интерпретации было бы полезно преобразовать DBS в эквиваленты плазмы.
Цельная кровь, собранная на фильтровальной бумаге, представляет собой более легкую и простую альтернативу взятию проб и может быть особенно привлекательной для врачей, находящихся далеко от медицинских центров.DBS широко используется для тестирования активности ферментов при ряде лизосомных болезней накопления. Двухуровневый ферментативный анализ в сочетании с дозировкой LysoSL может улучшить чувствительность и специфичность диагностического теста. Кроме того, было доказано, что тестирование DBS является быстрым и практичным методом выявления ряда лизосомных нарушений накопления при скрининге новорожденных [30]. В нашем центре мы проверяем новорожденных на наличие нескольких лизосомных заболеваний (болезни Гоше, Фабри, MPS I и болезни Помпе).Анализ LysoSL в DBS был предложен в качестве теста второго уровня при предположительно положительном результате и в качестве альтернативы более дорогостоящему и длительному генетическому тесту на FD, NPA / B и KD [8], [11], [18]. Предварительные данные показали, что HexSph в DBS может использоваться в качестве теста второго уровня для скрининга новорожденных GD.
Выводы
Таким образом, это исследование показало, что DBS-анализ с LC-MS / MS может быть выполнен для количественной оценки уровней LysoSL. DBS является эффективной матрицей для скрининга нескольких сфинголипидозов (FD, GD, KD и дефицита просапозина) с аналитическими характеристиками, сопоставимыми с таковыми плазмы, которая остается эталонной матрицей для определения LysoSL.Для LysoSM и LysoSM509 плазма оказалась лучше, чем DBS-скрининг NPC и NPA / B. Кроме того, этот метод можно использовать для терапевтического мониторинга или в качестве теста второго уровня при скрининге новорожденных.
Эта работа была поддержана Ассоциацией COMETA-ASMME (Associazione Studio Malattie Metaboliche Ereditarie). Авторы хотели бы поблагодарить доктора Мартину Занинотто за ее научную помощь.
Ссылки
1. Chamoles NA, Blanco M, Gaggioli D.Диагностика дефицита альфа-L-идуронидазы в сухих пятнах крови на фильтровальной бумаге: возможность диагностики новорожденных. Clin Chem 2001; 47: 780 LP – 1. Поиск в Google Scholar
2. Ройзер А.Дж., Верхейен Ф.В., Бали Д., ван Диггелен О.П., Жермен Д.П., Хву В.Л. и др. Использование образцов сухих пятен крови в диагностике лизосомных нарушений накопления — современное состояние и перспективы. Мол Генет Метаб (Elsevier Inc) 2011; 104: 144–8. Поиск в Google Scholar
3. Ли Й, Скотт К.Р., Чамолес Н.А., Гавами А., Пинто Б.М., Туречек Ф. и др.Прямой мультиплексный анализ лизосомальных ферментов в сухих пятнах крови для скрининга новорожденных. Clin Chem 2004; 50: 1785–96. Искать в Google Scholar
4. Spacil Z, Tatipaka H, Barcenas M, Scott CR, Turecek F, Gelb MH. Высокопроизводительный анализ 9 лизосомальных ферментов для скрининга новорожденных. Clin Chem 2013; 59: 502–11. Искать в Google Scholar
5. Пирауд М., Петтаццони М., Лавуа П., Рует С., Паган С., Чейлан Д. и др. Вклад тандемной масс-спектрометрии в диагностику лизосомных нарушений накопления.Журнал Наследие Metab Dis 2018; 41: 457–77. Поиск в Google Scholar
6. Аэртс Дж. М., Гренер Дж. Э., Койпер С., Донкер-Купман В. Е., Страйланд А., Оттенхофф Р. и др. Повышенный уровень глоботриаозилсфингозина является признаком болезни Фабри. Proc Natl Acad Sci 2008; 105: 2812–7. Искать в Google Scholar
7. Boutin M, Gagnon R, Lavoie P, Auray-Blais C. LC-MS / MS анализ плазменного лизо-Gb3 при болезни Фабри. Clin Chim Acta 2012; 414: 273–80. Искать в Google Scholar
8. Джонсон Б., Машер Х., Машер Д., Легнини Э., Хунг С.Й., Дайноки А. и др.Анализ лизоглоботриаозилсфингозина в сухих пятнах крови. Энн Лаб Мед 2013; 33: 274–8. Поиск в Google Scholar
9. Голд Х, Мирзаян М., Деккер Н., Жоао Ферраз М., Лугтенбург Дж., Коде Дж. Д. и др. Количественное определение глоботриаозилсфингозина в плазме и моче пациентов с синдромом Фабри с помощью сверхпроизводительной жидкостной хроматографии и тандемной масс-спектрометрии стабильных изотопов. Clin Chem 2013; 59: 547–56. Искать в Google Scholar
10. Smid BE, van der Tol L, Biegstraaten M, Linthorst GE, Hollak CE, Poorthuis BJ.Плазменный глоботриаозилсфингозин в отношении фенотипов болезни Фабри. J Med Genet 2015; 52: 262–8. Поиск в Google Scholar
11. Чуанг В.Л., Пачеко Дж., Чжан XK, Мартин М.М., Биски К.К., Койцер Дж. М. и др. Определение концентрации психозина в засохших пятнах крови новорожденных, которые при скрининге новорожденных были идентифицированы как группы риска по болезни Краббе. Clin Chim Acta 2013; 419: 73–6. Искать в Google Scholar
12. Turgeon CT, Orsini JJ, Sanders KA, Magera MJ, Langan TJ, Escolar ML, et al.Измерение психозина в засохших пятнах крови — возможное улучшение программ скрининга новорожденных на болезнь Краббе. Журнал Наследие Metab Dis 2015; 38: 923–9. Искать в Google Scholar
13. Игису Х., Судзуки К. Анализ галактозилсфингозина (психозина) в мозге. J. Lipid Res 1984; 25: 1000–6. Искать в Google Scholar
14. Деккер Н., ван Дуссен Л., Холлак С.Е., Оверклифт Х., Шейдж С., Гаухарали К. и др. Повышенный уровень глюкозилсфингозина в плазме при болезни Гоше: связь с фенотипом, маркерами накопительных клеток и терапевтическим ответом.Кровь 2011; 118: e118–27. Искать в Google Scholar
15. Рольфс А., Гизе А.К., Гриттнер У., Машер Д., Эльштейн Д., Зимран А. и др. Глюкозилсфингозин является высокочувствительным и специфическим биомаркером для первичной диагностики и последующего наблюдения за болезнью Гоше в нееврейской кавказской когорте пациентов с болезнью Гоше. PLoS One 2013; 8: e79732. Искать в Google Scholar
16. Фуллер М., Сзер Дж., Старк С., Флетчер Дж. М.. Быстрая однофазная экстракция глюкозилсфингозина из плазмы: универсальный инструмент для скрининга и мониторинга.Clin Chim Acta 2015; 450: 6–10. Поиск в Google Scholar
17. Мирзаян М., Виссе П., Ферраз М.Дж., Голд Х., Донкер-Купман В.Е., Верхук М. и др. Масс-спектрометрическое количественное определение глюкозилсфингозина в плазме и моче пациентов Гоше 1 типа с использованием изотопного стандарта. Клетки крови Mol Dis 2015; 54: 307–14. Искать в Google Scholar
18. Чуанг В.Л., Пачеко Дж., Купер С., Макговерн М.М., Кокс Г.Ф., Койцер Дж. И др. Лизо-сфингомиелин повышен в сухих пятнах крови пациентов Ниманна-Пика B.Mol Genet Metab 2014; 111: 209–11. Поиск в Google Scholar
19. Гизе А.К., Машер Х., Гриттнер У., Эйхлер С., Крамп Г., Лукас Дж. И др. Новый высокочувствительный и специфический биомаркер болезни Ниманна-Пика типа С1. Орфанет Ж. Редкие Диск 2015; 10: 78. Искать в Google Scholar
20. Поло Г., Бурлина А. П., Коламуннаге Т. Б., Зампиери М., Диониси-Вичи С., Стришуглио П. и др. Диагностика сфинголипидозов: новое одновременное измерение лизосфинголипидов с помощью LC-MS / MS. Clin Chem Lab Med 2017; 55: 403–14.Искать в Google Scholar
21. Петтаццони М., Фруассар Р., Паган С., Ванье М. Т., Руэ С., Латур П. и др. Мультиплексный анализ LC-MS / MS лизосфинголипидов в плазме и околоплодных водах: новый инструмент для скрининга сфинголипидозов и болезни Ниманна-Пика типа C. PLoS One 2017; 12: 1–19. Искать в Google Scholar
22. Вооринк-Морет М., Горден С.М., ван Куйленбург А.Б., Вейбург Ф.А., Гаухарали-ван дер Влугт Дж. М., Бирс-Стет Ф.С. и др. Экспресс-скрининг нарушений накопления липидов с использованием биохимических маркеров.Данные экспертного центра и обзор литературы. Мол Генет Метаб 2017; 123: 76–84. Искать в Google Scholar
23. Гаспар П., Коде Дж. Д., ван дер Марель Г., Оверклефт Х.С., Аэртс Дж. М.. Одновременное количественное определение сфингоидных оснований с помощью UPLC-ESI-MS / MS с идентичными внутренними стандартами, закодированными 13C. Clin Chim Acta 2017; 466: 178–84. Искать в Google Scholar
24. Мотта М., Татти М., Фурлан Ф., Селато А., Ди Фрушио Дж., Поло Дж. И др. Клиническая, биохимическая и молекулярная характеристика недостаточности просапозина.Clin Genet 2016; 90: 220–9. Искать в Google Scholar
25. Smid BE, Van der Tol L, Biegstraaten M, Linthorst GE, Hollak CE, Poorthuis BJ. Плазменный глоботриаозилсфингозин в отношении фенотипов болезни Фабри. J Med Genet 2015; 52: 262–8. Искать в Google Scholar
26. Дуро Дж., Зиццо К., Каммарата Дж., Бурлина А., Бурлина А., Поло Г. и др. Мутации в гене GLA и LysoGb3: действительно ли это болезнь Андерсона-Фабри? Int J Mol Sci 2018; 19: 3726. Искать в Google Scholar
27.Новак А., Мехтлер Т., Каспер Д.К., Десник Р.Дж. Корреляция уровней Lyso-Gb3 в сухих пятнах крови и сыворотках от пациентов с классической болезнью Фабри и с поздним началом. Мол Генет Метаб 2017; 121: 320–4. Искать в Google Scholar
28. Санторо М., Модони А., Сабателли М., Мадиа Ф, Пьемонте Ф., Тоцци Дж. И др. Хронический ганглиозидоз GM2 типа Sandhoff, связанный с новой миссенс-мутацией гена HEXB, вызывающей двойной патогенный эффект. Мол Генет Метаб 2007; 91: 111–4. Искать в Google Scholar
29.Велфорд Р.В., Гарзотти М., Маркес Лоуренсо С., Менгель Э., Марквард Т., Реунерт Дж. И др. Плазменный лизосфингомиелин демонстрирует большой потенциал в качестве диагностического биомаркера болезни Ниманна-Пика типа C в ретроспективном исследовании. PLoS One 2014; 9: e114669. Искать в Google Scholar
30. Бурлина А.Б., Поло Г., Сальвиати Л., Дуро Г., Зиццо С., Дардис А. и др. Скрининг новорожденных на лизосомные нарушения накопления с помощью тандемной масс-спектрометрии в Северо-Восточной Италии. Журнал Наследие Metab Dis 2018; 41: 209–19. Искать в Google Scholar
31.Кухар Л., Сикора Дж., Гулинелло М.Э., Поупетова Х., Луговска А., Малинова В. и др. Количественное определение плазматического лизосфингомиелина и лизосфингомиелина-509 для дифференциального скрининга болезней Ниманна-Пика A / B и C. Анальная Биохимия 2017; 525: 73–7. Поиск в Google Scholar
32. Цзян X, Сидху Р., Мидок-МакГрейн Л., Сюй Ф., Кови Д.Ф., Шеррер Д.Э. и др. Разработка скрининга новорожденных на основе желчных кислот на болезнь Ниманна-Пика типа C. Sci Transl Med 2016; 8: 337–63. Искать в Google Scholar
33.Mazzacuva F, Mills P, Mills K, Camuzeaux S, Gissen P, Nicoli ER и др. Идентификация новых желчных кислот как биомаркеров для ранней диагностики болезни Ниманна-Пика C. FEBS Lett 2016; 590: 1651–62. Искать в Google Scholar
34. Арендс М., Вейбург Ф.А., Ваннер К., Ваз FM, ван Куйленбург А.Б., Хьюз Д.А. и др. Благоприятный эффект раннего по сравнению с поздним началом заместительной ферментной терапии на уровни глоботриаозилсфингозина в плазме у мужчин с классической болезнью Фабри. Мол Генет Метаб 2017; 121: 157–61.Поиск в Google Scholar
35. ван Бримен М.Дж., Ромбах С.М., Деккер Н., Поортуис Б.Дж., Линторст Г.Е., Цвиндерман А.Х. и др. Снижение уровня глоботриаозилсфингозина в плазме у пациентов с классической болезнью Фабри после ферментной заместительной терапии. Biochim Biophys Acta Mol Basis Dis 2011; 1812: 70–6 Поиск в Google Scholar
36. Smid BE, Ferraz MJ, Verhoek M, Mirzaian M, Wisse P, Overkleeft HS, et al. Биохимический ответ на терапию по снижению субстрата по сравнению с заместительной ферментной терапией у пациентов с болезнью Гоше 1 типа.Orphanet J Rare Dis 2016; 11:28. Искать в Google Scholar
37. Мистри П.К., Лукина Э., Бен Туркиа Х., Шанкар С.П., Барис Х., Гон М. и др. Результаты после 18 месяцев терапии элиглюстатом у взрослых, не получавших лечения, с болезнью Гоше 1 типа: фаза 3 исследования ENGAGE. Am J Hematol 2017; 92: 1170–6. Искать в Google Scholar
Дополнительные материалы
В онлайн-версии этой статьи есть дополнительные материалы (https://doi.org/10.1515/cclm-2018-1301).
Поступила: 06.12.2018
Принято: 14.04.2019
Опубликовано в сети: 15.05.2019
Напечатано в печати: 26.11.2019
© 2019 Альберто Б.Burlina et al., Издательство De Gruyter, Берлин / Бостон
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 License.
У Солнца есть гейзер «Старый Верный» из плазмы
Солнце — это бурлящий, кипящий шар плазмы, постоянно взбалтывающийся и выворачивающийся наизнанку, когда веревки силовых линий магнитного поля запутываются и ломаются на его поверхности, высвобождая огромное количество энергии. Солнечные пятна, специфическое солнечное явление, могут содержать гейзеры или места повторяющейся активности выброса.Происхождение этих солнечных гейзеров оставалось загадкой на протяжении десятилетий, но новые исследования начинают проливать свет на эти спастические явления.
Магнитное Солнце
Солнце содержит наиболее сильно намагниченную среду в Солнечной системе. Эта интенсивность вызвана двумя наборами движений в кишечнике нашей звезды. Во-первых, горячая плазма около внутреннего ядра Солнца поднимается (точно так же, как горячий воздух в комнате) к поверхности, где сталкивается лицом к лицу с ошеломляющим холодом космического вакуума.После охлаждения эта плазма становится более плотной и скользит обратно в ядро, готовая начать процесс заново.
Другое движение — это вращение самого солнца. Поскольку Солнце не является твердым телом, как Земля, разные части вращаются с разной скоростью, а плазма на экваторе вращается быстрее, чем материя на полюсах.
Эта комбинация взбалтывания вовнутрь-наружу и скручивания, вызванного различиями во вращении, может значительно усилить магнитные поля и связать их в скрученные веревки чистой магнитной энергии.Когда напряжение в этих «веревках» становится слишком большим, силовые линии магнитного поля ломаются, высвобождая эту энергию в виде рентгеновских лучей и, в некоторых случаях, кинетический сдвиг, когда куски самого Солнца выбрасываются в космос.
Связано: Что внутри солнца? Звездный тур изнутри
Соединение и повторное соединение
Солнечные пятна — это регионы с особенно интенсивной магнитной активностью. Это места, где спутанные веревки силовых линий магнитного поля протыкают поверхность самого Солнца.Там магнитные силы могут препятствовать попаданию газа на поверхность. Не имея возможности участвовать в обычной цепочке конвекции, эти участки охлаждаются на несколько тысяч градусов, представляясь нам темными пятнами на поверхности Солнца.
Но сами пятна очень хаотичны. Внутри солнечных пятен сильное магнитное поле давит на турбулентную плазму Солнца, как рука, прижатая к океанской воде во время шторма. Эти события настолько экстремальны, что некоторые области солнечных пятен запускают струи плазмы вдали от поверхности Солнца — подвиг, требующий большого количества энергии и значительной концентрации магнитных сил.
Интересно, что иногда регионы около солнечных пятен могут запускать несколько струй по регулярному образцу, подобному гейзеру «Старый верный», найденному в Йеллоустонском национальном парке (но при температурах на тысячи градусов выше и с использованием плазмы, а не пара).
Источник этой регулярной активности перед лицом такой турбулентной, хаотической среды долгое время был загадкой для солнечных астрофизиков, и для объяснения этих явлений возникли две основные школы мысли.
Согласно одной точке зрения, появление плазменного гейзера является результатом внезапного чрезмерного воздействия магнитной энергии, дестабилизирующего окружающую среду вокруг солнечного пятна, что приводит к образованию струи.Затем магнитный паттерн, который был раньше, пытается вновь заявить о себе, временно подавляя ошибочную магнитную активность, прежде чем снова подавиться в постоянном возвратно-поступательном движении, что приводит к регулярному и повторяющемуся образованию струи.
Согласно другой точке зрения, это не столько соревнование магнетических желаний, сколько удачная возможность. При всей хаотической магнитной активности иногда сгустки магнитных полей движутся в противоположных направлениях, пересекаются и идеально нейтрализуют друг друга в определенном месте.Когда его ничто не удерживает, плазма под ним может взорваться, выстрелить наружу, прочь от поверхности Солнца.
Сложная взаимосвязь
Оба объяснения кажутся вполне правдоподобными, и с годами оба собрали доказательства, подтверждающие их. Но в новой статье, которая недавно была принята к публикации в The Astrophysical Journal и , размещенной в онлайновой базе данных препринтов arXiv , утверждается, что ответ лежит не в одном из этих направлений, а в обоих.
Изучив серию из 10 гейзеров, проросших в течение 24 часов, авторы исследования смогли изучить детальную магнитную структуру поверхности Солнца при образовании каждого взрыва, сравнивая то, что они видели в смещении и турбулентные магнитные поля к предсказаниям сценария «появления» и сценария «отмены».
Сценарий «появления» мог бы произойти, если бы исследователи увидели магнитные поля, нарастающие в определенном месте. В этом случае они увидят появление активности, ведущей к запуску реактивного самолета.
Сценарий «отмены» произошел бы, если бы исследователи увидели магнитные структуры, движущиеся в противоположных направлениях до запуска, что указывало бы на то, что отмена сыграла важную роль.
Исследователи обнаружили, что примерно в половине случаев происходило наращивание, а в половине случаев — гашение, происходящее в одном и том же месте солнечного пятна и приводящее к разным взрывам одного и того же гейзера.
Как это часто бывает, когда природе предлагаются два убедительных варианта, она выбирает… оба.

 Это исключает вероятность появления повреждений на матрице.
Это исключает вероятность появления повреждений на матрице. Единственный выход – замена поврежденных комплектующих.
Единственный выход – замена поврежденных комплектующих.

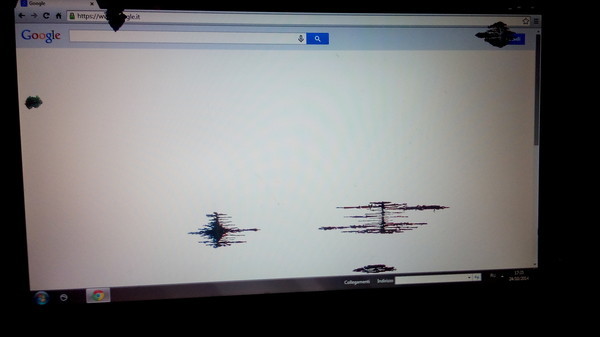 Это наиболее часто встречающаяся причина появления цветовых искажений на экране.
Это наиболее часто встречающаяся причина появления цветовых искажений на экране. Это обусловлено конструкцией экрана (невозможностью обеспечения равномерной подсветки по всей его площади) и технологией производства. Причем с ростом диагонали эффект проявляется более выразительно.
Это обусловлено конструкцией экрана (невозможностью обеспечения равномерной подсветки по всей его площади) и технологией производства. Причем с ростом диагонали эффект проявляется более выразительно. Как правило, засветы появляются при просмотре темных сцен в темном помещении. Включение торшера, ночника или настольной лампы может в принципе решить проблему с их появлением;
Как правило, засветы появляются при просмотре темных сцен в темном помещении. Включение торшера, ночника или настольной лампы может в принципе решить проблему с их появлением; Откручивание винтов на 1-2 оборота снимает напряжение с корпуса телевизора и может существенно улучшить ситуацию с их появлением;
Откручивание винтов на 1-2 оборота снимает напряжение с корпуса телевизора и может существенно улучшить ситуацию с их появлением;