Фосфорилирование — Википедия
Материал из Википедии — свободной энциклопедии
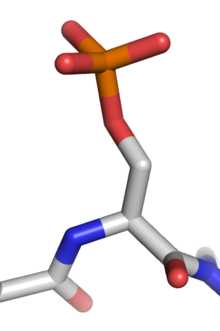 Фосфорилирование серина
Фосфорилирование серинаФосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты[1]:
- АТФ + R-OH → АДФ + R-OPO3H2
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает её или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамидадениндинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для её последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Обратимое фосфорилирование боковых цепей аминокислот — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков сигнальных путей. Считается, что фосфорилированию подвержено около трети всех белков эукариот.
О существовании фосфопротеинов было известно уже в конце XIX века. В то время считалось, что их функция — аккумуляция питательных веществ, так как фосфоказеин был обнаружен в молоке, а фосфовитины — в яичном желтке. Только в 50-х годах XX века стало понятно, что фосфопротеины распространены повсеместно. В 1954 году в эксперименте по фосфорилированию казеина гомогенатом митохондрий из клеток печени крысы было показано, что фосфорилирование белков имеет ферментативный характер
Под реакцией фосфорилирования белка понимают присоединение фосфатной группы через фосфоэфирную связь (О-фосфорилирование) к гидроксильной группе боковой цепи остатка серина, треонина или тирозина, донором фосфата при этом является АТФ. В подавляющем большинстве случаев фосфорилирование происходит именно по этим трём аминокислотным остаткам. Однако в природе встречается также фосфорилирование по остаткам гистидина и аргинина (N-фосфорилирование), аспартата и глутамата (A-фосфорилирование)
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
ru.wikipedia.org
Фосфорилирование — это… Что такое Фосфорилирование?
Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента- донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию эфиров фосфорной кислоты[1]:
- АТФ + R-OH АДФ + R-OPO3H2
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает ее или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамиддинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для ее последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Фосфорилирование белков
Обратимое фосфорилирование боковых цепей аминокислот — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков сигнальных путей. Считается, что фосфорилированию подвержено около трети всех белков эукариот.
О существовании фосфопротеинов было известно уже в конце XIX века. В то время считалось, что их функция — аккумуляция питательных веществ, так как фосфоказеин был обнаружен в молоке, а фосфовитины — в яичном желтке. Только в 50-х годах ХХ века стало понятно, что фосфопротеины распространены повсеместно. В 1954 году в эксперименте по фосфорилированию казеина гомогенатом митохондрий из клеток печени крысы было показано, что фосфорилирование белков имеет ферментативный характер[2]. Исторически первым было открыто фосфорилирование белков по остаткам серина, затем стало известно фосфорилирование по остаткам треонина. Первая тирозиновая киназа была открыта в 1980 году, это был продукт гена
Под реакцией фосфорилирования белка понимают присоединение фосфатной группы через фосфоэфирную связь (О-фосфорилирование) к гидроксильной группе боковой цепи остатка серина, треонина или тирозина, донором фосфата при этом является АТФ. В подавляющем большинстве случаев фосфорилирование происходит именно по этим трём аминокислотным остаткам. Однако в природе встречается также фосфорилирование по остаткам гистидина и аргинина (N-фосфорилирование), аспартата и глутамата (A-фосфорилирование)[4]. Образующиеся при фосфорилировании эфиры фосфорной кислоты весьма стабильны, поэтому для их разрушения необходимы специальные ферменты – протеинфосфатазы. Это создаёт основания для тонкой регуляции уровня фосфорилированности белка с помощью контроля за уровнем соответствующих протеинкиназ и протеинфосфатаз.
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
См. также
Примечания
Фосфорилирование — Howling Pixel
Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты[1]:
- АТФ + R-OH → АДФ + R-OPO3H2
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает её или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамидадениндинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для её последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Фосфорилирование белков
Обратимое фосфорилирование боковых цепей аминокислот — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков сигнальных путей. Считается, что фосфорилированию подвержено около трети всех белков эукариот.
О существовании фосфопротеинов было известно уже в конце XIX века. В то время считалось, что их функция — аккумуляция питательных веществ, так как фосфоказеин был обнаружен в молоке, а фосфовитины — в яичном желтке. Только в 50-х годах XX века стало понятно, что фосфопротеины распространены повсеместно. В 1954 году в эксперименте по фосфорилированию казеина гомогенатом митохондрий из клеток печени крысы было показано, что фосфорилирование белков имеет ферментативный характер[2]. Исторически первым было открыто фосфорилирование белков по остаткам серина, затем стало известно фосфорилирование по остаткам треонина. Первая тирозиновая киназа была открыта в 1980 году, это был продукт гена src вируса саркомы Рауса[3].
Под реакцией фосфорилирования белка понимают присоединение фосфатной группы через фосфоэфирную связь (О-фосфорилирование) к гидроксильной группе боковой цепи остатка серина, треонина или тирозина, донором фосфата при этом является АТФ. В подавляющем большинстве случаев фосфорилирование происходит именно по этим трём аминокислотным остаткам. Однако в природе встречается также фосфорилирование по остаткам гистидина и аргинина (N-фосфорилирование), аспартата и глутамата (A-фосфорилирование)[4]. Образующиеся при фосфорилировании эфиры фосфорной кислоты весьма стабильны, поэтому для их разрушения необходимы специальные ферменты – протеинфосфатазы. Это создаёт основания для тонкой регуляции уровня фосфорилированности белка с помощью контроля за уровнем соответствующих протеинкиназ и протеинфосфатаз.
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
Примечания
- ↑ phosphorylation // IUPAC Gold Book
- ↑ Burnett, G. and Kennedy, E.P. The enzymatic phosphorylation of proteins (англ.) // J Biol Chem : journal. — 1954. — Vol. 211. — P. 969—980. — PMID 13221602.
- ↑ Hunter, T. and Sefton, B.M. Transforming gene product of Rous sarcoma virus phosphorylates tyrosine (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1980. — Vol. 77. — P. 1311—1315. — PMID 6246487.
- ↑ Arena, S., Benvenuti, S., and Bardelli, A. Genetic analysis of the kinome and phosphatome in cancer (англ.) // Cell Mol Life Sci : journal. — 2005. — Vol. 62. — P. 2092—2099. — DOI:10.1007/s00018-005-5205-1. — PMID 16132230.
На других языках
This page is based on a Wikipedia article written by authors
(here).
Text is available under the CC BY-SA 3.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
howlingpixel.com
Фосфорилирование • ru.knowledgr.com
Фосфорилирование — добавление фосфата (ПО) группа к белку или другой органической молекуле (см. также: органофосфат). Фосфорилирование включает много ферментов белка и прочь, таким образом изменяя их функцию и деятельность. Фосфорилирование белка — один тип постпереводной модификации.
Фосфорилирование белка в особенности играет значительную роль в широком диапазоне клеточных процессов. Его видная роль в биохимии — предмет очень большого объема исследований (с марта 2012, база данных Medline возвращает почти 200 000 статей о предмете, в основном о фосфорилировании белка).
Фосфорилирование белка
История
В 1906 Фоебус Левен в Институте Рокфеллера Медицинского Исследования определил фосфат в белке vitellin (phosvitin), и к 1933 обнаружил phosphoserine в казеине с Фрицем Липманом. Однако это взяло за еще 20 лет до того, как Юджин П. Кеннеди описал первое ‘ферментативное фосфорилирование белков’.
Функция
Обратимое фосфорилирование белков — важный регулирующий механизм, который происходит и в прокариотических и в эукариотических организмах.
Белки фосфорилата киназ и фосфатазы dephosphorylate белки. Много ферментов и рецепторов включены или «прочь» фосфорилированием и dephosphorylation. Обратимое фосфорилирование приводит к конформационному изменению в структуре во многих ферментах и рецепторах, заставляя их стать активированным или дезактивированным. Фосфорилирование обычно происходит на серине, треонине, тирозине и остатках гистидина в эукариотических белках. Фосфорилирование гистидина эукариотических белков, кажется, намного более частое, чем фосфорилирование тирозина. В прокариотических белках фосфорилирование происходит на серине, треонине, тирозине, гистидине или остатках лизина или аргинине. Добавление фосфата (ПО) молекула полярной группе R остатка аминокислоты может превратить гидрофобную часть белка в полярную и чрезвычайно гидрофильньную часть молекулы. Таким образом это может ввести конформационное изменение в структуре белка через взаимодействие с другими гидрофобными и гидрофильньными остатками в белке.
Одним таким примером регулирующей роли, которую играет фосфорилирование, является p53 белок подавителя опухоли. p53 белок в большой степени отрегулирован и содержит больше чем 18 различных мест фосфорилирования. Активация p53 может привести к аресту клеточного цикла, который может быть полностью изменен при некоторых обстоятельствах или apoptotic некрозе клеток. Эта деятельность происходит только в ситуациях в чем, клетка повреждена, или физиология нарушена в нормальных здоровых людях.
На сигнал дезактивации белок становится dephosphorylated снова и прекращает работать. Это — механизм во многих формах трансдукции сигнала, например путь, которым поступающий свет обработан в светочувствительных клетках сетчатки.
Регулирующие роли фосфорилирования включают
- Биологическая термодинамика требующих энергии реакций
- Фосфорилирование Na/K-ATPase во время транспортировки натрия (На) и калий (K) ионы через клеточную мембрану в osmoregulation, чтобы поддержать гомеостаз содержания воды тела.
- Добивается запрещения фермента
- Фосфорилирование фермента GSK-3 AKT (Киназа белка B) как часть инсулина сигнальный путь.
- Фосфорилирование src киназы тирозина (объявил «sarc») C-терминалом, киназа Src (Csk) вызывает конформационное изменение в ферменте, приводящем к сгибу в структуре, которая маскирует ее область киназы, и таким образом отключен.
- Важный для взаимодействия белка белка через «области признания».
- Фосфорилирование цитозольных компонентов оксидазы NADPH, большой направляющийся мембраной, фермент мультибелка, существующий в phagocytic клетках, играет важную роль в регулировании взаимодействий белка белка в ферменте.
- Важный в деградации белка.
- В конце 1990-х, это было признано, что фосфорилирование некоторых белков заставляет их быть ухудшенными ЗАВИСИМЫМ ОТ ATP ubiquitin/proteasome путем. Эти целевые белки становятся основаниями для особого E3 ubiquitin ligases только, когда они — phosphorylated.
Сигнальные сети
Объяснение сложных сигнальных событий фосфорилирования пути может быть трудным. В клеточных сигнальных путях, белок белок фосфорилатов B и фосфорилаты B C. Однако в другом сигнальном пути, белок D фосфорилаты A или белок фосфорилатов C. Глобальные подходы, такие как phosphoproteomics, исследование phosphorylated белков, которое является небольшим филиалом протеомики, объединенной с основанной на масс-спектрометрии протеомикой, были использованы, чтобы определить и определить количество динамических изменений в phosphorylated белках в течение долгого времени. Эти методы становятся все более и более важными для систематического анализа сложных сетей фосфорилирования. Они успешно использовались, чтобы определить динамические изменения в статусе фосфорилирования больше чем 6 000 мест после стимуляции с эпидермальным фактором роста.
Другой подход для понимания Сети Фосфорилирования, измеряя генетические взаимодействия между многократными phosphorylating белками и их целями. Это показывает интересные повторяющиеся образцы взаимодействий – сетевые мотивы. Вычислительные методы были развиты, чтобы смоделировать сети фосфорилирования и предсказать их ответы под различными волнениями.
Места фосфорилирования белка
Есть тысячи отличных мест фосфорилирования в данной клетке с тех пор:
1) Есть тысячи различных видов белков в любой особой клетке (таких как лимфоцит).
2) Считается, что 1/10 к 1/2 белков — phosphorylated (в некотором клеточном государстве).
3) Одно исследование указывает, что 30% белков в геноме человека могут быть phosphorylated, и неправильное фосфорилирование теперь признано причиной человеческой болезни.
4) Фосфорилирование часто происходит на многократных отличных территориях на данном белке.
Так как фосфорилирование любого места на данном белке может изменить функцию или локализацию того белка, поняв, что «государство» клетки требует знания государства фосфорилирования его белков. Например, если Серин аминокислоты 473 («S473») в белке, AKT — phosphorylated, AKT, в целом, функционально активен как киназа. В противном случае это — бездействующая киназа.
Типы фосфорилирования
См. также киназы для получения дополнительной информации о различных типах фосфорилирования
В пределах белка фосфорилирование может произойти на нескольких аминокислотах. Фосфорилирование на серине наиболее распространено, сопровождается треонином. Фосфорилирование тирозина относительно редко, но является в происхождении фосфорилирования белка сигнальными путями у большинства эукариотов. Однако начиная с тирозина phosphorylated белки относительно легки очистить антитела использования, места фосфорилирования тирозина относительно хорошо поняты. Фосфорилирование гистидина и аспартата происходит у прокариотов как часть двухкомпонентной передачи сигналов и в некоторых случаях у эукариотов в некоторых путях трансдукции сигнала.
Обнаружение и характеристика
Антитела могут использоваться в качестве мощных инструментов, чтобы обнаружить, является ли белок phosphorylated на особом месте. Антитела связывают с и обнаруживают вызванные фосфорилированием конформационные изменения в белке. Такие антитела называют phospho-определенными антителами; сотни таких антител теперь доступны. Они становятся критическими реактивами и для фундаментального исследования и для клинического диагноза.
PTM (Постпереводная Модификация) изоформы легко обнаружены на 2D гелях. Действительно, фосфорилирование заменяет нейтральные гидроксильные группы на серинах, треонинах или тирозинах с отрицательно обвиненными фосфатами с pKs около 1.2 и 6.5. Таким образом, ниже pH фактора 5.5, фосфаты добавляют единственный отрицательный заряд; около pH фактора 6.5, они добавляют 1,5 отрицательных заряда; выше pH фактора 7.5, они добавляют 2 отрицательных заряда. Относительная сумма каждой изоформы может также легко и быстро быть определена от окрашивания интенсивности на 2D гелях.
В некоторых очень конкретных случаях обнаружении фосфорилирования, поскольку изменение в электрофоретической подвижности белка возможно на простых 1-мерных гелях СТРАНИЦЫ SDS, как это описано, например, для транскрипционного coactivator Kovacs и др. Сильные связанные с фосфорилированием конформационные изменения (которые сохраняются в содержащих моющее средство решениях), как думают, лежат в основе этого явления. Большинство мест фосфорилирования, для которых такое изменение подвижности было описано падение категории SP и мест TP (т.е. остаток пролина следует за phosphorylated серином или остатком треонина).
Позже крупномасштабные исследования масс-спектрометрии использовались, чтобы определить места фосфорилирования белка. За прошлые 4 года десятки исследований были изданы, каждая идентификация тысячи мест, многие из которых были ранее не описаны. Масс-спектрометрия идеально подходит для таких исследований, используя HCD или фрагментацию ETD как добавление результатов фосфорилирования в увеличении массы белка и phosphorylated остатка. Современные, очень точные массовые спектрометры необходимы для этих исследований, ограничивая технологию лабораториями с высококачественными массовыми спектрометрами. Однако анализ phosphorylated пептидов масс-спектрометрией все еще не как прямой что касается «регулярных», неизмененных пептидов. Недавно, EThcD был развит, объединив передачу электрона и разобщение столкновения более высокой энергии. По сравнению с обычными методами фрагментации схема EThcD обеспечивает более информативные спектры MS/MS для однозначной phosphosite локализации.
Подробная характеристика мест фосфорилирования очень трудная, и количественный анализ фосфорилирования белка масс-спектрометрией требует изотопических внутренних стандартных подходов. Относительный количественный анализ может быть получен со множеством отличительных технологий маркировки изотопа. Есть также несколько количественных методов фосфорилирования белка, включая иммунологические обследования флюоресценции, Микромасштаб Thermophoresis, РАЗДРАЖЕНИЕ, TRF, поляризация флюоресценции, подавление флюоресценции, изменение подвижности, основанное на бусинке обнаружение и основанные на клетке форматы.
Другие виды
ATP, «высокоэнергетическая» обменная среда в клетке, синтезируется в митохондрии добавлением третьей группы фосфата к АВТОМАТИЧЕСКОЙ ОБРАБОТКЕ в процессе, называемом окислительным фосфорилированием. ATP также синтезируется фосфорилированием уровня основания во время glycolysis.
ATP синтезируется за счет солнечной энергии фотофосфорилированием в хлоропластах растительных клеток.
Фосфорилирование сахара часто — первая стадия их катаболизма. Это позволяет клеткам накапливать сахар, потому что группа фосфата препятствует тому, чтобы молекулы распространились назад через их транспортер.
См. также
- Сохранение половины
Внешние ссылки
- Функциональные исследования для определенного для места фосфорилирования целевого белка в клетках (Протокол)
ru.knowledgr.com
Первичная, вторичная, третичная, четвертичная структура белка. Каркасная часть белка. Глобулярные белки. Полиморфные белки. Нуклеопротеиды. α-спираль. Параллельный и антипараллельный β-лист. Смешанные β-структуры. Модифицирование белков. Ферменты. Донор и субстрат. Фосфорилирование. Пролин. Фосфатная группа. Киназы. Протеинфосфатазы. Глюкокиназа. Креатин. Креатинкиназа. Креатинфосфат.
Когда белки только производятся в клетке, они представляют собой длинную цепочку последовательно соединенных друг с другом аминокислот (такая структура белка называется первичной), но аминокислоты сами по себе имеют свои химические и физические свойства, поэтому уже в процессе изготовления этой цепочки отдельные ее элементы начинают между собой взаимодействовать, в результате чего белок начинает постепенно превращаться из первичной в намного более сложную структуру – вторичную. При этом между разными аминокислотами возникают связи, которые и стабилизируют вторичную структуру, поэтому они не хаотичны, а складываются в хорошо узнаваемые формы. Самая распространенная форма вторичной структуры – альфа-спираль (α-спираль). Конечно, у этой спирали бывают и искажения, и изгибы, вызванные как электростатическим взаимодействием между собой некоторых аминокислот, так и другими аминокислотными структурными особенностями, но все же спираль выглядит довольно правильной структурой за счет того, что она стабилизирована водородными связями, которые возникают между каждой аминогруппой каркасной части (т.е. не входящей в состав радикалов) и карбонильной группой (C=O) аминокислоты, находящейся на 4 аминокислоты раньше:
На схемах α-спираль так и обозначают – схематичной спиралькой. Есть и другие разновидности спиральной укладки.
Вторым по распространенности способом пространственной организации вторичной структуры белка является «бета-лист» (β-лист), представляющий собою складчатые, почти плоские слои, состоящие из как минимум двух лежащих рядом цепочек, связанных друг с другом водородными связями между группами C=O и N-H каркасных частей. Два типичных способа укладки первичной структуры в β-лист – параллельный и антипараллельный:
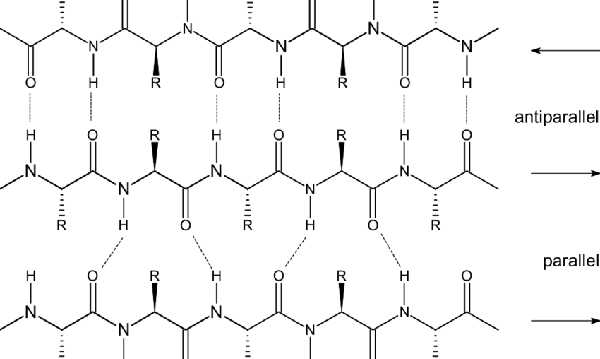
(термин «антипараллельный» кажется явно неудачным, но так уж исторически сложилось и прижилось). В антипараллельных полипептидных цепочках N-концы направлены в противоположные стороны. Встречаются и смешанные β-структуры, состоящие из параллельных и антипараллельных цепочек.
Складчатые листы обычно бывают совсем немного закрученными. На рисунках β-цепочки изображаются в виде плоских стрелок. Соседние β-цепочки соединены между собою короткой цепочкой в виде изогнутой жесткой «скобы», состоящей из нескольких аминокислотных остатков:
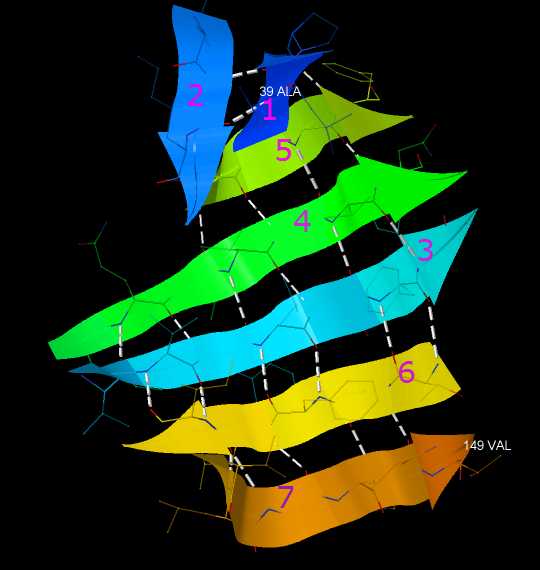
и для того, чтобы этот изгиб «скобки» оставался жестким, поддерживая правильную структуру β-листа, в этих местах используется аминокислота с самой жесткой структурой – пролин (Pro), (P).
Есть несколько вариаций укладки β-листов, но сейчас это неважно, а вот формулу пролина мы как раз, пользуясь случаем, и выучим:
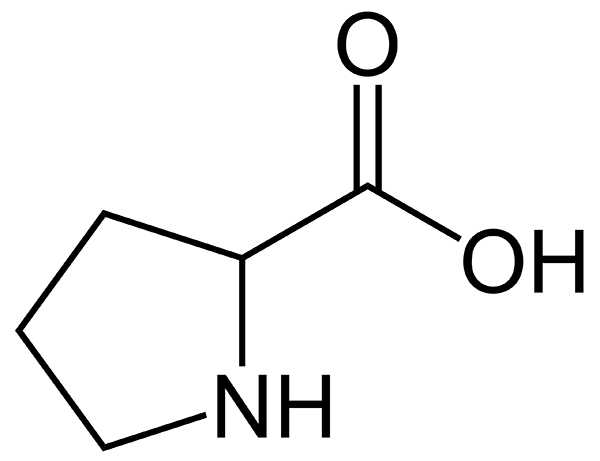
Как видно, это очень странная аминокислота. Строго говоря, опираясь на букву правил, это даже и не аминокислота вовсе, а иминокислота, но нам сейчас удобнее не акцентировать внимание на таких мелочах. Мы уже знаем, что у пролина жесткая структура, значит следовало бы ожидать, что мы обнаружим его повышенное содержание в таких белках, которые должны упрочнять биоткани. И в самом деле, его очень много в основном белке соединительной ткани — в коллагене. Мнемонический прием: «прочный пролин».
В белках мы нередко можем видеть такую структуру, где совмещены и α-спирали и β-листы, и линейные одноцепочечные короткие участки и т.д.:
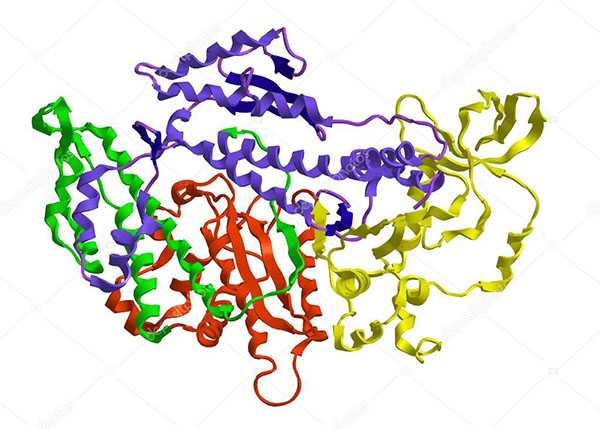
На этом рисунке мы видим, что белок не просто представляет собою набор спиралей и листов, лежащих на столе, а свернулся в сложную глобулярную структуру (глобулярные белки — это белки, свернутые в «глобулы» — компактные объемные структуры). Такая сложно-свернутая структура называется третичной. Вообще третичные структуры могут быть очень разными и причудливыми по своей форме.
Принимая третичную форму, белки часто объединяются с рибонуклеиновыми кислотами (РНК), образуя очень сложные комплексы – нуклеопротеиды:
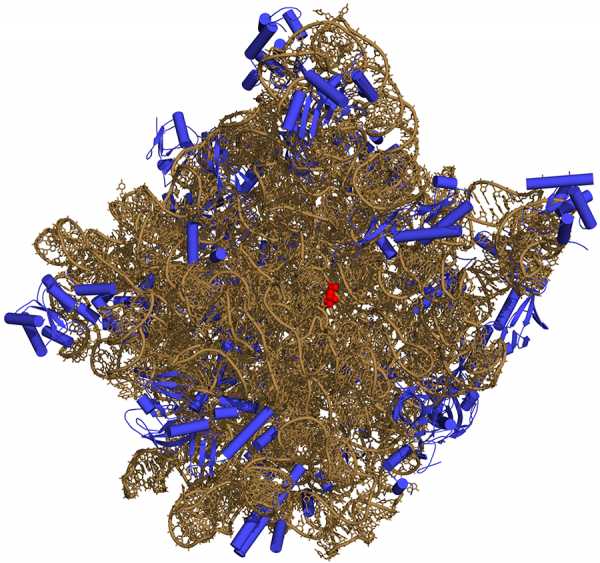
(здесь коричневое – РНК, а синее — белок). И когда объединяются два (или более) белка (или нуклеопротеида), находящиеся в своей третичной форме, тогда образуется белковый конгломерат, который обычно называют четвертичной структурой белка, хотя это не совсем логично, ведь тут несколько белков, а не один:

Понятно, что функция белка будет сильно зависеть именно от первичной структуры – от аминокислотной последовательности, из которой он состоит, но эта зависимость носит довольно смягченный характер, так как во многих случаях эту последовательность можно менять в довольно широких пределах, и при этом белок или вообще не изменит своих функций, или станет работать лишь немного хуже. С эволюционной точки зрения это очень выгодно, ведь какими бы совершенными ни были механизмы считывания информации с ДНК, как бы безупречно ни работала рибосома, строящая белок в соответствии с этой информацией, ошибки все же очень редко, но возникают, и вместо одной аминокислоты в белковую цепь может быть вставлена другая. Но мы же видим, насколько огромными бывают белки, и состоят они из разных участков – какой-то участок является важным элементом структуры белка, а другой – средневажным, а третий и вовсе маловажным. Какой-то участок принимает самое активное участие в осуществлении функции белка, а другой достаточно пассивен. Так что во многих случаях одна неправильная аминокислота просто ничего не меняет, а порой и целые неверные совокупности аминокислот почти не ухудшают свойств белка. Да и белков определенного типа в клетке – сотни, тысячи, и даже если несколько десятков будут построены с грубой ошибкой, то это ничего не изменит в жизни клетки.
А вот если произойдет мутация в самой ДНК, т.е. если сама генетическая информация будет немного испорчена, тогда все белки, изготавливаемые по схеме испорченного гена, будут не совсем правильными, и тут уже все будет зависеть от масштаба дефекта. Но и здесь ситуация облегчается тем, что в организме, как правило, есть целые семейства схожих белков, и если одно семейство производится с серьезным дефектом, то клетка просто будет более активно производить схожие по функции белки с другого, родственного или дублирующего гена. Ко всему этому надо добавить, что некоторые аминокислоты почти взаимозаменяемы, так как обладают схожими функциями. В итоге почти 30% всех белков у людей являются полиморфными, т.е. имеют некоторые различия.
Бывает и так, что белки, значительно отличающиеся и первичной структурой, и размером, выполняют схожие функции. Это можно объяснить тем, что белок может выполнять свою работу, используя лишь небольшой участок — активный центр, а структура его остальных частей не так уж и важна.
В клетке белки выполняют невероятное количество самых разных функций, и при этом они могут немного видоизменяться для того, чтобы более успешно выполнить ту или иную операцию. Такое небольшое изменение белка называется модифицированием. В процессе модифицирования белка к одному, или к нескольким его аминокислотным остаткам ковалентной (т.е. прочной) связью присоединяется та или иная небольшая химическая группа. В клетках всеми подобными модифицированиями и многими прочими операциями занимаются особые белки, относящиеся к классу «ферментов». От того – какая именно молекула присоединена к белку, и в каком именно месте она присоединена, зависит многое: насколько белок будет активен или пассивен, насколько он будет стабилен, с какими другими белками будет взаимодействовать, в какое место клетки отправится работать, и будет ли он вообще сохраняться в клетке, или будет разобран на аминокислоты.
Объект, на который некий фермент переносит некую группу атомов, называется субстратом, а объект, у которого забрали эту группу, чтобы перенести её на субстрат, предсказуемо называется донором.
Различных способов ковалентных модификаций белков очень много. На данный момент известно более 200! Ситуация еще более усложняется тем, что один белок может быть подвергнут сразу нескольким типам модификаций. Такое изобилие возможностей позволяет клетке минимизировать число разных белков, не плодить их до бесконечности, создавая отдельный белок для выполнения одной и той же функции при различных условиях окружающей среды. Гораздо эффективней приспосабливать один белок к выполнению немного отличающихся функций при разных обстоятельствах (нам тоже удобнее иметь одну дрель с 20-ю сменными сверлами, чем 20 дрелей). Таким образом четкость специализации белков дополняется их структурной гибкостью.
Самым распространенным видом модификации белков является фосфорилирование – как минимум 30% всех белков подвергаются такой модификации в нужное клетке время, когда тот или иной белок надо активизировать или, наоборот, выключить из работы. Для того, чтобы осуществить фосфорилирование белка, надо перенести на него фосфатную группу (или, иначе, «фосфат») PO4
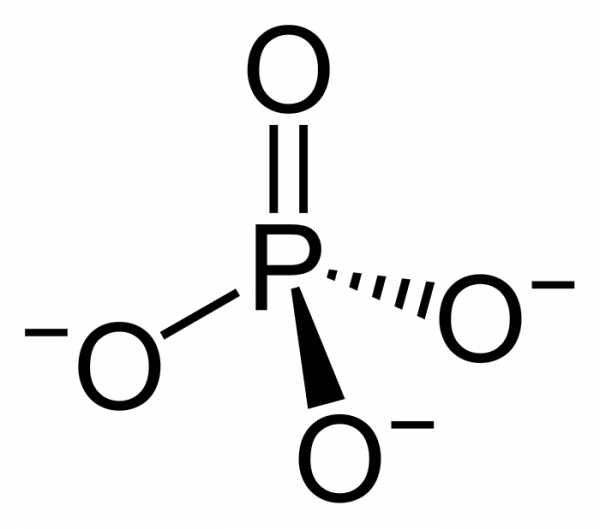
Так, например, возьмем тирозин, уберем его водород из гидроксильной группы, и прикрепим вместо него фосфат. Таким образом мы получим фосфорилированный тирозин, который теперь называется фосфотирозин. Переносом фосфата на какую-либо молекулу занимаются киназы (еще их называют фосфотрансферазы, т.е. «осуществляющие трансфер фосфата»). Мнемоническое правило: «по команде фас киназа кинется переносить фосфат».
Процесс «отъема» фосфатной группы называется дефосфорилированием. Если субстратом киназы является любой белок, то такие киназы называются протеинкиназами, и отсюда ясно, что протеинкиназы являются разновидностью (подклассом) киназ.
Протеинкиназа, фосфорилирующая тирозин, называется «тирозиновая киназа» или «тирозинкиназа» — тут логика понятна. Есть такой подкласс протеинкиназ, который занимается фосфорилированием лишь отдельной аминокислоты (например серина, треонина или тирозина – самых главных субстратов протеинкиназ), а есть протеинкиназы тройной специфичности (фосфорилирующие остатки всех трех этих аминокислот). Позже, когда мы узнаем формулы серина и треонина, станет легко запомнить, что именно серин, треонин и тирозин являются главными субстратами протеинкиназ, ведь именно эти три аминокислоты содержат гидроксил, к которому и цепляется фосфат.
Так как фосфорилирование – самый распространенный вид модификации белков, то можно предположить, что и разнообразных протеинкиназ должно быть довольно много. И в самом деле – в нашем геноме около 500 генов (т.е. 2% от всего их количества!) несут информацию о постройке протеинкиназ.
Протеинкиназы создают значительную активность в клетке, причем их собственная активность тоже может регулироваться фосфорилированием, и они фосфорилируют друг друга. Они даже умеют фосфорилировать сами себя (самофосфорилирование)! Влияя на активность белков, протеинкиназы суют свой нос практически во все углы клетки и участвуют в регулировании множества клеточных процессов. Несложно понять, что если какие-то из генов протеинкиназ повреждены, это может приводить к тяжелым заболеваниям, включая некоторые виды рака.
Для того, чтобы перенести фосфатную группу на аминокислоту, киназа забирает её у особой, исключительно важной молекулы АТФ (о ней позже), после чего переносит на субстрат (например на тирозин, входящий в состав субстратного белка), и так происходит фосфорилирование белка. Но что происходит, если теперь клетке надо произвести его дефосфорилирование? Этим тоже должен заняться особый фермент, и это – протеинфосфатаза. Например, протеинфосфатаза, отнимающая фосфат у тирозина, называется тирозинфосфатазой. Любопытно, что очень часто бывает так, что тирозинкиназа имеет прямо в своем составе сопряженную с ней тирозинфосфатазу (ну или наоборот:) – что-то вроде двустороннего инструмента «молоток-гвоздодёр» — одной стороной инструмента можно забить гвоздь, а другой – вытащить его.
То, что киназы чаще всего переносят фосфат на гидроксильную группу, не означает, что они не могут прикреплять его к другим субстратам. Акцептором может быть и карбоксильная группа СООН, и атом азота, и другой фосфат.
Когда я съедаю тортик, в мою кровь поступает глюкоза. Многие знают, что в этой ситуации активизируются бета-клетки островков Лангерганса поджелудочной железы, выбрасывая в кровь инсулин. Результатом работы инсулина является быстрое снижение концентрации глюкозы в крови, и как именно это происходит, мы рассмотрим во всей своей полноте существенно позже, а пока коснемся лишь одного аспекта этой работы: инсулин стимулирует синтез глюкокиназы в гепатоцитах (клетках печени). Глюкокиназа занимается фосфорилированием глюкозы (а также фруктозы, маннозы и других шестиатомных сахаров), что кончается в итоге переводом лишней глюкозы крови в гликоген.
Для того, чтобы познакомиться с еще одной протеинкиназой, сначала выучим формулу важной карбоновой кислоты – креатина. Креатин интересен тем, что эта карбоновая кислота содержит много азота, и нам будет легко запомнить ее формулу, т.к. ее азотсодержащий хвост устроен очень «последовательно» (сгруппировавшаяся вокруг углерода группа N-NH-NH2).
Мнемоническое правило: «креатин поступил креативно — он запасся азотом, а метильной группой он как метлой заметает следы, чтобы никто не заметил, как много азота он прицепил». В будущем креатин нам еще пригодится при изучении структуры протеиногенной аминокислоты аргинина.
Креатинкиназа переносит фосфатную группу на креатин, и получается креатинфосфат (еще его называют креатинфосфорной кислотой).
Креатинфосфат (или фосфокреатин) – очень нужное нам вещество, т.к. он активно расходуется при повышенных физических нагрузках. Естественно, креатинфосфат в особенно большом количестве содержится в мышцах сердца и в скелетных мышцах, но также много его в головном мозге и в легких. Соответственно в организме резко повышается концентрация креатинкиназы в тех случаях, когда появляются травмы скелетных мышц, а также при инфаркте миокарда, ведь надо срочно восстанавливать работу травмированных мышц.
bodhi.name
Фосфорилирование белков — Справочник химика 21
Регуляторным ферментом гликогенолиза является гликогенфосфорилаза — первый фермент в катаболической цепи мобилизации гликогена. Этот фермент переводит углеводы из запасной формы в форму метаболически активную (фосфорилированную). Фермент фосфорилаза существует в двух формах, одна из которых (фосфорилаза а) активна, в то время как другая (фосфорилаза Ь) неактивна. Обе формы могут диссоциировать на одинаковые субъединицы. Фосфорилаза Ь состоит из двух субъединиц, а фосфорилаза а — из четырех. Превращение фосфорилазы Ь в фосфорилазу а осуществляется фосфорилированием белка по уравнению [c.251]Фосфорилирование фермента не отражается на ферментативной активности при pH 8,0. Однако фосфорилирование белка оказывает влияние на аллостерические свойства фермента повышается чувствительность к ингибированию АТФ и цитратом, но снижается чувствительность к активирующему действию АМФ и фруктозо-2,6-дифосфата. Предполагают, что фосфорилирование индуцирует конформацион-ные изменения, способствующие смещению равновесия между двумя формами фермента активной и неактивной. При связывании АТФ в ингибиторном центре также происходит смещение равновесия в сторону неактивной конформационной формы фосфофруктокиназы. [c.238] Биохимические функции. Адренокортикотропин воздействует на клетки надпочечников по мембрано-опосредованному механизму, вызывая стимуляцию синтеза и секреции кортикостероидов. Активация аденилатной системы и образование вторичного посредника цАМФ приводят к образованию активных протеинкиназ и фосфорилированию ряда цитоплазматических белков. Например, фосфорилирование эс-тераз приводит к их активации и освобождению холестерина. Кроме того, фосфорилирование белков рибосом приводит к интенсификации процессов трансляции и синтезу белка, в том числе и транспортера свободного холестерина в митохондрии, где и осуществляется синтез кортикостероидов (рис. 12.2). [c.146]
Открытие роли фосфорилирования белков как регулирующего механизма клеточного I метаболизма I [c.781]
Обычно считается, что лабильные микротрубочки цитоплазмы находятся в динамическом равнове
www.chem21.info
Фосфорилирование — Википедия
Материал из Википедии — свободной энциклопедии
 Фосфорилирование серина
Фосфорилирование серинаФосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты[1]:
- АТФ + R-OH → АДФ + R-OPO3H2
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает её или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамидадениндинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для её последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Фосфорилирование белков
Обратимое фосфорилирование боковых цепей аминокислот — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков сигнальных путей. Считается, что фосфорилированию подвержено около трети всех белков эукариот.
О существовании фосфопротеинов было известно уже в конце XIX века. В то время считалось, что их функция — аккумуляция питательных веществ, так как фосфоказеин был обнаружен в молоке, а фосфовитины — в яичном желтке. Только в 50-х годах XX века стало понятно, что фосфопротеины распространены повсеместно. В 1954 году в эксперименте по фосфорилированию казеина гомогенатом митохондрий из клеток печени крысы было показано, что фосфорилирование белков имеет ферментативный характер[2]. Исторически первым было открыто фосфорилирование белков по остаткам серина, затем стало известно фосфорилирование по остаткам треонина. Первая тирозиновая киназа была открыта в 1980 году, это был продукт гена src вируса саркомы Рауса[3].
Под реакцией фосфорилирования белка понимают присоединение фосфатной группы через фосфоэфирную связь (О-фосфорилирование) к гидроксильной группе боковой цепи остатка серина, треонина или тирозина, донором фосфата при этом является АТФ. В подавляющем большинстве случаев фосфорилирование происходит именно по этим трём аминокислотным остаткам. Однако в природе встречается также фосфорилирование по остаткам гистидина и аргинина (N-фосфорилирование), аспартата и глутамата (A-фосфорилирование)[4]. Образующиеся при фосфорилировании эфиры фосфорной кислоты весьма стабильны, поэтому для их разрушения необходимы специальные ферменты – протеинфосфатазы. Это создаёт основания для тонкой регуляции уровня фосфорилированности белка с помощью контроля за уровнем соответствующих протеинкиназ и протеинфосфатаз.
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
Примечания
wikipedia.green
