Фосфорилирование белков — Protein phosphorylation
Модель остатка фосфорилированного серина Серин в аминокислотной цепи до и после фосфорилирования.Фосфорилирование белка является обратимой посттрансляционной модификацией белков , в которых аминокислотный остаток , фосфорилированные с помощью белка киназы добавления ковалентно связанной фосфатной группы. Фосфорилирование изменяет структурную конформацию белка, заставляя его активироваться, деактивироваться или изменять его функцию. Приблизительно 13000 белков человека имеют участки, которые фосфорилируются.
Обратная реакция фосфорилирования называется дефосфорилированием и катализируется протеинфосфатазами . Протеинкиназы и фосфатазы работают независимо и сбалансированно, регулируя функцию белков.
Наиболее часто фосфорилируемыми аминокислотами являются серин , треонин , тирозин у эукариот, а также гистидин у прокариот и растений (хотя сейчас известно, что он часто встречается у людей).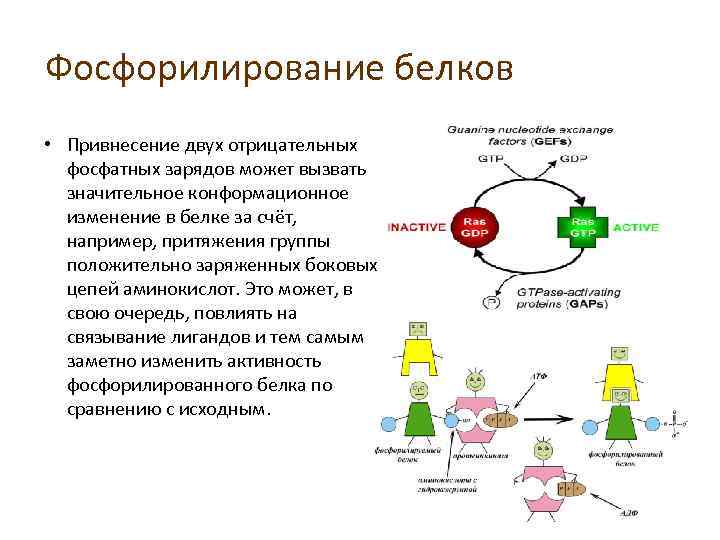
О фосфорилировании белков впервые сообщил в 1906 году Фебус Левен из Института медицинских исследований Рокфеллера с открытием фосфорилированного вителлина . Однако прошло почти 50 лет, прежде чем было открыто ферментативное фосфорилирование белков протеинкиназами.
История
В 1906 году Фибус Левен в Рокфеллеровского института медицинских исследований идентифицированы фосфат в белковом vitellin (фосвитина), а к 1933 году было обнаружено фосфосерина в казеина , с Фрица Липмана. Однако прошло еще 20 лет, прежде чем Юджин П. Кеннеди описал первое «ферментативное фосфорилирование белков». Первый фермент фосфорилаза был открыт Карлом и Герти Кори в конце 1930-х годов. Карл и Герти Кори обнаружили две формы гликогенфосфорилазы, которые они назвали А и В, но неправильно поняли механизм преобразования формы В в форму А. Взаимопревращение фосфорилазы b в фосфорилазу a было позже описано Эдмондом Фишером и Эдвином Кребсом , а также Wosilait и Sutherland с участием механизма фосфорилирования / дефосфорилирования. Было обнаружено, что фермент, названный киназой фосфорилазы и Mg-ATP, необходим для фосфорилирования гликогенфосфорилазы, способствуя переносу γ-фосфорильной группы АТФ к остатку серина на фосфорилазе b. Протеинфосфатаза 1 способна катализировать дефосфорилирование фосфорилированных ферментов за счет удаления фосфатной группы. Эрл Сазерленд объяснил в 1950 году, что активность фосфорилазы увеличивалась и, таким образом, стимулировался гликогенолиз, когда срезы печени инкубировали с адреналином и глюкагоном.
Однако прошло еще 20 лет, прежде чем Юджин П. Кеннеди описал первое «ферментативное фосфорилирование белков». Первый фермент фосфорилаза был открыт Карлом и Герти Кори в конце 1930-х годов. Карл и Герти Кори обнаружили две формы гликогенфосфорилазы, которые они назвали А и В, но неправильно поняли механизм преобразования формы В в форму А. Взаимопревращение фосфорилазы b в фосфорилазу a было позже описано Эдмондом Фишером и Эдвином Кребсом , а также Wosilait и Sutherland с участием механизма фосфорилирования / дефосфорилирования. Было обнаружено, что фермент, названный киназой фосфорилазы и Mg-ATP, необходим для фосфорилирования гликогенфосфорилазы, способствуя переносу γ-фосфорильной группы АТФ к остатку серина на фосфорилазе b. Протеинфосфатаза 1 способна катализировать дефосфорилирование фосфорилированных ферментов за счет удаления фосфатной группы. Эрл Сазерленд объяснил в 1950 году, что активность фосфорилазы увеличивалась и, таким образом, стимулировался гликогенолиз, когда срезы печени инкубировали с адреналином и глюкагоном.

Функции фосфорилирования
Фосфорилирование вводит заряженную гидрофильную группу в боковую цепь аминокислот, возможно, изменяя структуру белка, изменяя взаимодействие с соседними аминокислотами. Некоторые белки, такие как p53, содержат несколько сайтов фосфорилирования, облегчая сложную многоуровневую регуляцию. Из-за легкости, с которой белки могут быть фосфорилированы и дефосфорилированы, этот тип модификации представляет собой гибкий механизм, позволяющий клеткам реагировать на внешние сигналы и условия окружающей среды.
Обратимое фосфорилирование белков происходит как в прокариотических, так и в эукариотических организмах. Подсчитано, что у человека, мыши и дрожжей существует 230 000, 156 000 и 40 000 сайтов фосфорилирования соответственно. Киназы фосфорилируют белки, а фосфатазы дефосфорилируют белки. Многие ферменты и рецепторы «включаются» или «выключаются» за счет фосфорилирования и дефосфорилирования. Обратимое фосфорилирование приводит к конформационному изменению структуры многих ферментов и рецепторов , в результате чего они активируются или деактивируются. Фосфорилирование обычно происходит по остаткам серина , треонина , тирозина и гистидина в эукариотических белках. Фосфорилирование эукариотических белков гистидином происходит гораздо чаще, чем фосфорилирование тирозина. В прокариотических белках фосфорилирование происходит по остаткам серина, треонина, тирозина, гистидина или аргинина или лизина . Добавление молекулы фосфата (PO
Многие ферменты и рецепторы «включаются» или «выключаются» за счет фосфорилирования и дефосфорилирования. Обратимое фосфорилирование приводит к конформационному изменению структуры многих ферментов и рецепторов , в результате чего они активируются или деактивируются. Фосфорилирование обычно происходит по остаткам серина , треонина , тирозина и гистидина в эукариотических белках. Фосфорилирование эукариотических белков гистидином происходит гораздо чаще, чем фосфорилирование тирозина. В прокариотических белках фосфорилирование происходит по остаткам серина, треонина, тирозина, гистидина или аргинина или лизина . Добавление молекулы фосфата (PO 
Одним из таких примеров регуляторной роли, которую играет фосфорилирование, является белок-супрессор опухоли p53 . Р53 белок в значительной степени регулируется и содержит более 18 различных сайтов фосфорилирования. Активация р53 может привести к остановке клеточного цикла, который может быть обращен вспять при некоторых обстоятельствах, или к апоптотической гибели клеток. Эта активность происходит только в ситуациях, когда клетка повреждена или физиология нарушена у нормальных здоровых людей.
По сигналу дезактивации белок снова дефосфорилируется и перестает работать. Это механизм во многих формах передачи сигналов , например, в способе обработки входящего света в светочувствительных клетках сетчатки .
Регуляторные роли фосфорилирования включают:
- Биологическая термодинамика энергоемких реакций
- Фосфорилирование Na + / K + -АТФазы во время транспортировки ионов натрия (Na + ) и калия (K + ) через клеточную мембрану в процессе осморегуляции для поддержания гомеостаза содержания воды в организме.

- Фосфорилирование Na + / K + -АТФазы во время транспортировки ионов натрия (Na + ) и калия (K + ) через клеточную мембрану в процессе осморегуляции для поддержания гомеостаза содержания воды в организме.
- Опосредует ингибирование ферментов
- Фосфорилирование фермента GSK-3 с помощью AKT (протеинкиназа B) как часть пути передачи сигналов инсулина.
- Фосфорилирование тирозинкиназы src (произносится как «sarc») С-концевой киназой Src (Csk) вызывает конформационные изменения в ферменте, что приводит к складке в структуре, которая маскирует его киназный домен и, таким образом, «закрывается».
Мембранный транспорт
Деградация белков
Ферментативная регуляция (активация и ингибирование)
- Первым открытым примером регуляции белков посредством фосфорилирования была гликогенфосфорилаза . Эдди Фишер и Эд Кребс описали, как фосфорилирование гликогенфосфорилазы b превращает ее в активную гликогенфосфорилазу a. Вскоре было обнаружено, что гликогенсинтаза, еще один метаболический фермент, инактивируется фосфорилированием.
- Фосфорилирование фермента GSK-3 с помощью AKT (протеинкиназа B) как часть пути передачи сигналов инсулина.

- Фосфорилирование тирозинкиназы Src (произносится как «sarc») с помощью Csk (C-концевой киназы Src) инактивирует Src, вызывая конформационные изменения, которые маскируют его киназный домен.
- Фосфорилирование гистонов h3AX на серине 139 в пределах двух миллионов оснований (0,03% хроматина), окружающих двухцепочечный разрыв ДНК, необходимо для восстановления двухцепочечного разрыва. Фосфорилирование метилпурин-ДНК-гликозилазы по серину 172 необходимо для эксцизионной репарации повреждений алкилированных оснований.
Белковые взаимодействия
- Фосфорилирование цитозольных компонентов НАДФН-оксидазы , большого мембраносвязанного, мультибелкового фермента, присутствующего в фагоцитарных клетках , играет важную роль в регуляции белок-белковых взаимодействий в ферменте.
- Важен в деградации белка.
- В конце 1990-х было признано, что фосфорилирование некоторых белков вызывает их деградацию с помощью АТФ-зависимого пути убиквитин / протеасома .
 Эти белки-мишени становятся субстратами для определенных лигаз убиквитина Е3 только тогда, когда они фосфорилируются.
Эти белки-мишени становятся субстратами для определенных лигаз убиквитина Е3 только тогда, когда они фосфорилируются.
- В конце 1990-х было признано, что фосфорилирование некоторых белков вызывает их деградацию с помощью АТФ-зависимого пути убиквитин / протеасома .
Сигнальные сети
Выявление событий фосфорилирования сложных сигнальных путей может быть трудным. В клеточных сигнальных путях протеин A фосфорилирует протеин B, а B фосфорилирует C. Однако в другом сигнальном пути протеин D фосфорилирует A или фосфорилирует протеин C. Глобальные подходы, такие как фосфопротеомика , исследование фосфорилированных протеинов, которое является суб- филиал протеомики , в сочетании с масс — спектрометрией основанное протеомики, которые были использованы для идентификации и количественного определения динамических изменений в фосфорилированных белков с течением времени. Эти методы становятся все более важными для систематического анализа сложных сетей фосфорилирования. Они были успешно использованы для выявления динамических изменений статуса фосфорилирования более чем 6000 сайтов после стимуляции эпидермальным фактором роста . Другой подход к пониманию сети фосфорилирования заключается в измерении генетических взаимодействий между множественными фосфорилирующими белками и их мишенями. Это выявляет интересные повторяющиеся паттерны взаимодействий — сетевые мотивы. Вычислительные методы были разработаны для моделирования сетей фосфорилирования и прогнозирования их ответов при различных возмущениях.
Другой подход к пониманию сети фосфорилирования заключается в измерении генетических взаимодействий между множественными фосфорилирующими белками и их мишенями. Это выявляет интересные повторяющиеся паттерны взаимодействий — сетевые мотивы. Вычислительные методы были разработаны для моделирования сетей фосфорилирования и прогнозирования их ответов при различных возмущениях.
Фосфорилирование гистонов
Эукариотическая ДНК организована с гистоновыми белками в определенные комплексы, называемые хроматином. Структура хроматина функционирует и облегчает упаковку, организацию и распространение эукариотической ДНК. Однако он оказывает негативное влияние на несколько фундаментальных биологических процессов, таких как транскрипция, репликация и репарация ДНК, ограничивая доступность определенных ферментов и белков. Было показано, что посттрансляционная модификация гистонов, такая как фосфорилирование гистонов, изменяет структуру хроматина путем изменения взаимодействий белок: ДНК или белок: белок.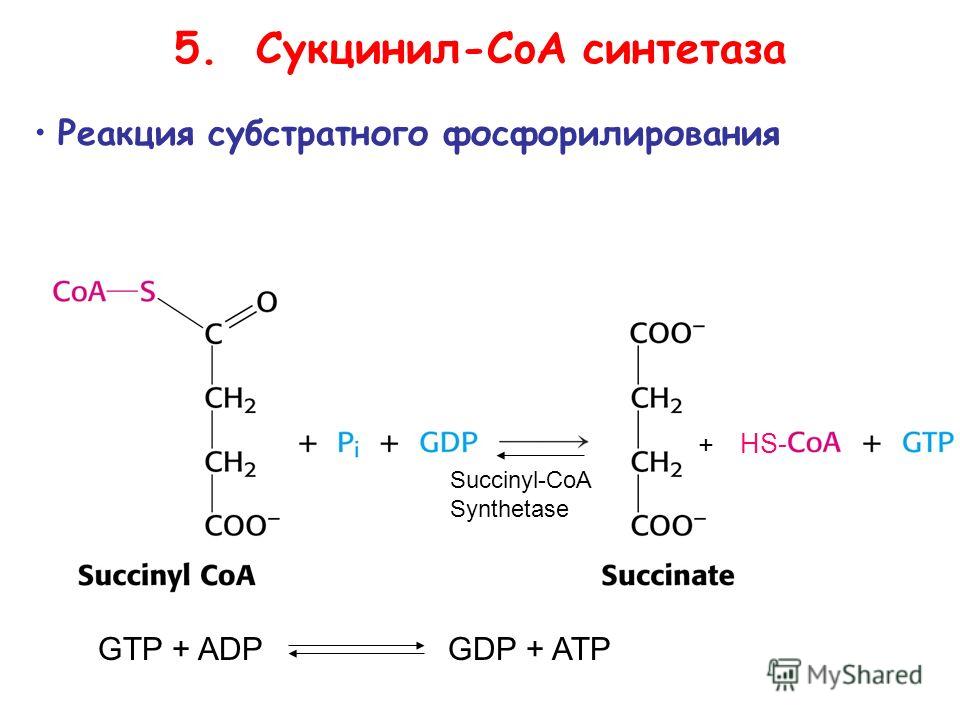 Посттрансляционные модификации гистонов изменяют структуру хроматина. Наиболее часто ассоциированное фосфорилирование гистонов происходит во время клеточных ответов на повреждение ДНК, когда фосфорилированный гистон h3A разделяет большие домены хроматина вокруг места разрыва ДНК. Исследователи выяснили, влияют ли модификации гистонов напрямую на транскрипцию, управляемую РНК-полимеразой II. Исследователи выбирают белки, которые, как известно, модифицируют гистоны, чтобы проверить их влияние на транскрипцию, и обнаружили, что индуцированная стрессом киназа, MSK1, ингибирует синтез РНК. Ингибирование транскрипции с помощью MSK1 было наиболее чувствительным, когда матрица находилась в хроматине, поскольку матрицы ДНК не в хроматине были устойчивы к эффектам MSK1. Было показано, что MSK1 фосфорилирует гистон h3A по серину 1, а мутация серина 1 в аланин блокирует ингибирование транскрипции с помощью MSK1. Таким образом, результаты свидетельствуют о том, что ацетилирование гистонов может стимулировать транскрипцию путем подавления ингибирующего фосфорилирования киназой, такой как MSK1.
Посттрансляционные модификации гистонов изменяют структуру хроматина. Наиболее часто ассоциированное фосфорилирование гистонов происходит во время клеточных ответов на повреждение ДНК, когда фосфорилированный гистон h3A разделяет большие домены хроматина вокруг места разрыва ДНК. Исследователи выяснили, влияют ли модификации гистонов напрямую на транскрипцию, управляемую РНК-полимеразой II. Исследователи выбирают белки, которые, как известно, модифицируют гистоны, чтобы проверить их влияние на транскрипцию, и обнаружили, что индуцированная стрессом киназа, MSK1, ингибирует синтез РНК. Ингибирование транскрипции с помощью MSK1 было наиболее чувствительным, когда матрица находилась в хроматине, поскольку матрицы ДНК не в хроматине были устойчивы к эффектам MSK1. Было показано, что MSK1 фосфорилирует гистон h3A по серину 1, а мутация серина 1 в аланин блокирует ингибирование транскрипции с помощью MSK1. Таким образом, результаты свидетельствуют о том, что ацетилирование гистонов может стимулировать транскрипцию путем подавления ингибирующего фосфорилирования киназой, такой как MSK1.
Киназы
Дополнительная информация: Киназа Внутри белка фосфорилирование может происходить по нескольким аминокислотам . Считается, что наиболее распространенным является фосфорилирование серина , за ним следует треонин . Фосфорилирование тирозина встречается относительно редко, но оно стоит во главе многих сигнальных путей фосфорилирования белков (например, в рецепторах, связанных с тирозинкиназой) у большинства эукариот. Фосфорилирование аминокислот, таких как серин, треонин и тирозин, приводит к образованию фосфопротеина, когда фосфатная группа фосфопротеина реагирует с группой -ОН боковой цепи Ser, Thr или Tyr в реакции этерификации . Однако, поскольку белки, фосфорилированные тирозином, относительно легко очистить с помощью антител , сайты фосфорилирования тирозина относительно хорошо изучены. Фосфорилирование гистидина и аспартата происходит у прокариот как часть двухкомпонентной передачи сигналов, а в некоторых случаях у эукариот — в некоторых путях передачи сигнала. Анализ фосфорилированного гистидина с использованием стандартных биохимических и масс-спектрометрических подходов намного сложнее, чем анализ Ser, Thr или Tyr . и У прокариот, архей и некоторых низших эукариот азот гистидина действует как нуклеофил и связывается с фосфатной группой. После фосфорилирования гистидина регуляторный домен регулятора ответа катализирует перенос фосфата в аспартат.
Анализ фосфорилированного гистидина с использованием стандартных биохимических и масс-спектрометрических подходов намного сложнее, чем анализ Ser, Thr или Tyr . и У прокариот, архей и некоторых низших эукариот азот гистидина действует как нуклеофил и связывается с фосфатной группой. После фосфорилирования гистидина регуляторный домен регулятора ответа катализирует перенос фосфата в аспартат.
Рецепторные тирозинкиназы
Тирозинкиназа рецептора AXL, демонстрирующая симметрию димеризованных рецепторов Хотя фосфорилирование тирозина обнаруживается в относительно низком количестве, оно хорошо изучено из-за простоты очистки фосфотирозина с помощью антител . Рецепторные тирозинкиназы представляют собой важное семейство рецепторов клеточной поверхности, участвующих в передаче внеклеточных сигналов, таких как гормоны, факторы роста и цитокины. Связывание лиганда с тирозинкиназой мономерного рецептора стабилизирует взаимодействия между двумя мономерами с образованием димера , после чего два связанных рецептора фосфорилируют остатки тирозина в транс . Фосфорилирование и активация рецептора активируют сигнальный путь за счет ферментативной активности и взаимодействия с адапторными белками. Передача сигналов через рецептор эпидермального фактора роста (EGFR) , рецепторную тирозинкиназу, имеет решающее значение для развития многих систем органов, включая кожу, легкие, сердце и мозг. Избыточная передача сигналов через путь EGFR обнаруживается при многих раковых заболеваниях человека.
Фосфорилирование и активация рецептора активируют сигнальный путь за счет ферментативной активности и взаимодействия с адапторными белками. Передача сигналов через рецептор эпидермального фактора роста (EGFR) , рецепторную тирозинкиназу, имеет решающее значение для развития многих систем органов, включая кожу, легкие, сердце и мозг. Избыточная передача сигналов через путь EGFR обнаруживается при многих раковых заболеваниях человека.
Циклинзависимые киназы
Циклинзависимые киназы (CDK) представляют собой серин-треониновые киназы, которые регулируют прохождение цикла эукариотических клеток . CDK каталитически активны только при связывании с регуляторным циклином . Клетки животных содержат по крайней мере девять различных CDK, которые со значительной специфичностью связываются с различными циклинами. Ингибиторы CDK (CKI) блокируют активность киназы в комплексе циклин-CDK, чтобы остановить клеточный цикл в G1 или в ответ на сигналы окружающей среды или повреждение ДНК. Активность различных CDK активирует клеточные сигнальные пути и факторы транскрипции, которые регулируют ключевые события митоза, такие как фазовый переход G1 / S. Более ранние комплексы циклин-CDK дают сигнал для активации последующих комплексов циклин-CDK.
Активность различных CDK активирует клеточные сигнальные пути и факторы транскрипции, которые регулируют ключевые события митоза, такие как фазовый переход G1 / S. Более ранние комплексы циклин-CDK дают сигнал для активации последующих комплексов циклин-CDK.
Места
В данной клетке есть тысячи различных сайтов фосфорилирования, поскольку:
- В каждой конкретной клетке (например, в лимфоците ) есть тысячи различных белков .
- Подсчитано, что от 1/10 до 1/2 белков фосфорилируются (в некоторых клеточных состояниях).
- Независимые исследования показывают, что 30-65% белков в геноме человека и ~ 50% белков в геноме дрожжей могут быть фосфорилированы.
- Статистический анализ многочисленных экспериментов с высокой и низкой производительностью показал, что у человека, мыши и дрожжей существует 230000, 156000 и 40000 сайтов фосфорилирования соответственно.
- Фосфорилирование часто происходит на нескольких разных участках данного белка.

Поскольку фосфорилирование любого сайта данного белка может изменить функцию или локализацию этого белка, понимание «состояния» клетки требует знания состояния фосфорилирования ее белков. Например, если аминокислота серин-473 («S473») в белке AKT фосфорилирована, AKT , как правило, функционально активна как киназа. В противном случае это неактивная киназа.
Сайты фосфорилирования имеют решающее значение для белков, их транспортировки и функций. Они представляют собой ковалентную модификацию белков посредством обратимого фосфорилирования. Это позволяет белкам оставаться в клетке, поскольку отрицательный фосфорилированный сайт препятствует их проницаемости через клеточную мембрану. Дефосфорилирование белка позволяет клетке пополнять запасы фосфатов за счет высвобождения пирофосфатов, что экономит использование АТФ в клетке. Пример фосфорилирующего фермента обнаружен у бактерий E. coli . Он обладает щелочной фосфатазой в периплазматической области своей мембраны. Самая внешняя мембрана проницаема для фосфорилированных молекул, однако внутренняя цитоплазматическая мембрана непроницаема из-за больших отрицательных зарядов. Таким образом, бактерии E. coli накапливают белки и пирофосфаты в своей периплазматической мембране до тех пор, пока они не потребуются внутри клетки.
Самая внешняя мембрана проницаема для фосфорилированных молекул, однако внутренняя цитоплазматическая мембрана непроницаема из-за больших отрицательных зарядов. Таким образом, бактерии E. coli накапливают белки и пирофосфаты в своей периплазматической мембране до тех пор, пока они не потребуются внутри клетки.
Недавний прогресс в фосфопротеомной идентификации привел к открытию бесчисленных сайтов фосфорилирования в белках. Это потребовало интегративной среды для доступных данных, в которой организованы известные сайты фосфорилирования белков. Была создана тщательно подобранная база данных dbPAF, содержащая известные сайты фосфорилирования в H. sapiens , M. musculus , R. norvegicus , D. melanogaster , C. elegans , S. pombe и S. cerevisiae . База данных в настоящее время содержит 294 370 неизбыточных сайтов фосфорилирования 40 432 белков. Другие инструменты прогнозирования фосфорилирования белков включают NetPhos для эукариот , NetPhosBac для бактерий и ViralPhos для вирусов.
Серин / треонин
Существует большое разнообразие остатков серина, и фосфорилирование каждого остатка может привести к различным метаболическим последствиям.
- Протеинкиназа N1 отвечает за фосфорилирование фактора, ассоциированного с рецептором TNF (TRAF1) на серине 139 в определенных условиях. Мышиный TRAF1 также фосфорилируется той же киназой, что приводит к подавлению активности IKK / NF-κB. Устранение фосфорилирования серина 139 может быть достигнуто путем замены TRAF1 остатком аланина, что, следовательно, приводит к улучшенному привлечению TBK1.
- По остатку серина 789 FGFR1 фосфорилируется RSK2, когда киназа находится в своей активной форме. Возможности передачи сигналов FGFR1 в сайте серина 777 могут быть ослаблены фосфорилированием. Серин 1047 и серин 1048 связаны со снижением аффинности связывания убиквитинлигазы c-Cbl с EFGR, когда они фосфорилируются.
- Когда серин 349 фосфорилируется, сродство связывания между белковым комплексом p62 и белком Keap1 усиливается, что связано со стрессовой реакцией.

- Когда серин 337 фосфорилируется протеинкиназой A in vitro, эффективность связывания ДНК субъединицы p50 NF-κB значительно увеличивается.
Известно, что фосфорилирование остатков серина и треонина перекрестно с модификацией O -GlcNAc остатков серина и треонина.
Тирозин
Фосфорилирование тирозина быстро реагирует, и реакцию можно обратить. Являясь одним из основных регуляторных механизмов в передаче сигналов — росте , дифференцировке , миграции и метаболическом гомеостазе клеток, — клеточные процессы поддерживаются фосфорилированием тирозина. Функция протеинтирозинкиназ и протеин-тирозинфосфатазы уравновешивает уровень фосфотирозина на любом протеине. Нарушение работы определенных цепей протеинтирозинкиназ и протеинтирозинфосфатазы было связано с множеством заболеваний человека, такими как ожирение , инсулинорезистентность и сахарный диабет 2 типа . Фосфорилирование тирозина происходит не только у эукариот, но было обнаружено, что оно происходит у некоторых видов бактерий и присутствует среди прокариот . Фосфорилирование тирозина поддерживает клеточную регуляцию у бактерий, аналогичную его функции у эукариот.
Фосфорилирование тирозина поддерживает клеточную регуляцию у бактерий, аналогичную его функции у эукариот.
Аргинин
Фосфорилирование аргинина у многих грамположительных бактерий маркирует белки для разложения протеазой Clp .
Неканоническое фосфорилирование His, Asp, Cys, Glu, Arg и Lys в клетках человека
Недавние исследования лаборатории Клэр Э. Эйерс подтверждают широко распространенное фосфорилирование человеческого белка по множеству неканонических аминокислот, включая мотивы, содержащие фосфорилированный гистидин (1 и 3 положения), аспартат, цистеин, глутамат, аргинин и лизин в экстрактах клеток HeLa. Из-за химической и термической лабильности этих фосфорилированных остатков для сохранения наряду с термостабильным «классическим» фосфорилированием Ser, Thr и Tyr требуются специальные процедуры и методы разделения.
Обнаружение и характеристика
Антитела можно использовать как мощный инструмент для определения того, фосфорилируется ли белок в определенном месте. Антитела связываются с белком и обнаруживают вызванные фосфорилированием конформационные изменения. Такие антитела называются фосфоспецифическими антителами; сейчас доступны сотни таких антител. Они становятся важнейшими реагентами как для фундаментальных исследований, так и для клинической диагностики.
Антитела связываются с белком и обнаруживают вызванные фосфорилированием конформационные изменения. Такие антитела называются фосфоспецифическими антителами; сейчас доступны сотни таких антител. Они становятся важнейшими реагентами как для фундаментальных исследований, так и для клинической диагностики.
Изоформы посттрансляционной модификации (ПТМ) легко обнаруживаются на 2D-гелях . Действительно, фосфорилирование заменяет нейтральные гидроксильные группы серинов, треонинов или тирозинов на отрицательно заряженные фосфаты с pKs около 1,2 и 6,5. Таким образом, при pH ниже 5,5 фосфаты добавляют один отрицательный заряд; около pH 6,5 они добавляют 1,5 отрицательных заряда; выше pH 7,5 они добавляют 2 отрицательных заряда. Относительное количество каждой изоформы также можно легко и быстро определить по интенсивности окрашивания на 2D-гелях.
В некоторых очень конкретных случаях обнаружение фосфорилирования как сдвига в электрофоретической подвижности белка возможно на простых одномерных гелях SDS-PAGE, как это описано, например, для транскрипционного коактиватора Kovacs et al. Считается, что в основе этого феномена лежат сильные конформационные изменения, связанные с фосфорилированием (которые сохраняются в растворах, содержащих детергент). Большинство сайтов фосфорилирования, для которых описан такой сдвиг подвижности, попадают в категорию сайтов SP и TP (т.е. остаток пролина следует за остатком фосфорилированного серина или треонина).
Совсем недавно крупномасштабные масс-спектрометрические анализы стали использоваться для определения участков фосфорилирования белков. За последние 4 года были опубликованы десятки исследований, каждое из которых идентифицирует тысячи сайтов, многие из которых ранее не были описаны. Масс-спектрометрия идеально подходит для таких анализов с использованием фрагментации HCD или ETD , поскольку добавление фосфорилирования приводит к увеличению массы белка и фосфорилированного остатка. Для этих исследований необходимы современные высокоточные масс-спектрометры, поэтому технология ограничивается лабораториями с масс-спектрометрами высокого класса. Однако анализ фосфорилированных пептидов с помощью масс-спектрометрии все еще не так прост, как для «обычных» немодифицированных пептидов. Недавно был разработан EThcD , сочетающий перенос электрона и столкновительную диссоциацию при более высоких энергиях. По сравнению с обычными методами фрагментации, схема EThcD обеспечивает более информативные МС / МС спектры для однозначной локализации фосфозита.
Для этих исследований необходимы современные высокоточные масс-спектрометры, поэтому технология ограничивается лабораториями с масс-спектрометрами высокого класса. Однако анализ фосфорилированных пептидов с помощью масс-спектрометрии все еще не так прост, как для «обычных» немодифицированных пептидов. Недавно был разработан EThcD , сочетающий перенос электрона и столкновительную диссоциацию при более высоких энергиях. По сравнению с обычными методами фрагментации, схема EThcD обеспечивает более информативные МС / МС спектры для однозначной локализации фосфозита.
Детальная характеристика сайтов фосфорилирования очень трудна, а количественное определение фосфорилирования белка с помощью масс-спектрометрии требует подходов к изотопному внутреннему стандарту. Относительное количественное определение может быть получено с помощью различных технологий дифференциальной маркировки изотопов. Существует также несколько методов количественного фосфорилирования белков, включая флуоресцентный иммуноанализ, термофорез на микромасштабах , FRET , TRF, поляризацию флуоресценции, тушение флуоресценции, сдвиг подвижности, детектирование на основе гранул и форматы на основе клеток.
Эволюция
Фосфорилирование белков характерно для всех видов жизни, включая всех животных, растения, грибы, бактерии и археи. Происхождение механизмов фосфорилирования белков является наследственным и сильно различается между разными видами. У эукариот, по оценкам, от 30 до 65% всех белков могут быть фосфорилированы с десятками или даже сотнями тысяч различных сайтов фосфорилирования. Некоторые сайты фосфорилирования, по-видимому, эволюционировали как условные выключатели, блокирующие активный центр фермента, например, в прокариотическом метаболическом ферменте изоцитратдегидрогеназе. Однако в случае белков, которые должны быть фосфорилированы, чтобы быть активными, менее ясно, как они могли возникнуть от нефосфорилированных предков. Было показано, что часть сериновых фосфозитов часто заменяется кислотными остатками, такими как аспартат и глутамат, между различными видами. Эти анионные остатки могут взаимодействовать с катионными остатками, такими как лизин и аргинин, с образованием солевых мостиков , стабильных нековалентных взаимодействий, которые изменяют структуру белка. Эти фосфозиты часто участвуют в солевых мостиках, предполагая, что некоторые сайты фосфорилирования эволюционировали как условные переключатели для солевых мостиков, позволяя этим белкам принимать активную конформацию только в ответ на определенный сигнал.
Эти фосфозиты часто участвуют в солевых мостиках, предполагая, что некоторые сайты фосфорилирования эволюционировали как условные переключатели для солевых мостиков, позволяя этим белкам принимать активную конформацию только в ответ на определенный сигнал.
Существует около 600 известных эукариотических протеинкиназ, что делает их одним из крупнейших семейств генов. Большая часть фосфорилирования осуществляется одним суперсемейством протеинкиназ, которые разделяют консервативный домен киназы. Фосфорилирование белков является высококонсервативным в путях, имеющих ключевое значение для выживания клеток, таких как развитие клеточного цикла, основанное на циклин-зависимых киназах (CDK), но отдельные сайты фосфорилирования часто бывают гибкими. Мишени фосфорилирования CDK часто имеют фосфозиты в неупорядоченных сегментах , которые обнаруживаются в неидентичных местах даже у близких видов. Напротив, мишени фосфорилирования CDK в структурно определенных областях более консервативны. Хотя активность CDK имеет решающее значение для роста и выживания клеток у всех эукариот, только очень немногие фосфозиты демонстрируют сильную консервацию их точного положения. Позиционирование, вероятно, будет очень важно для фосфатов, которые аллостерически регулируют структуру белка, но гораздо более гибким для фосфатов, которые взаимодействуют с фосфопептид-связывающими доменами для рекрутирования регуляторных белков.
Хотя активность CDK имеет решающее значение для роста и выживания клеток у всех эукариот, только очень немногие фосфозиты демонстрируют сильную консервацию их точного положения. Позиционирование, вероятно, будет очень важно для фосфатов, которые аллостерически регулируют структуру белка, но гораздо более гибким для фосфатов, которые взаимодействуют с фосфопептид-связывающими доменами для рекрутирования регуляторных белков.
Сравнение эукариот и прокариот
Фосфорилирование белков — это обратимая посттрансляционная модификация белков. У эукариот фосфорилирование белков влияет на передачу сигналов, экспрессию генов и дифференцировку. Он также участвует в репликации ДНК во время клеточного цикла и в механизмах, которые справляются с блоками репликации, вызванными стрессом. По сравнению с эукариотами, прокариоты используют киназы и фосфатазы типа Хэнкса для передачи сигналов. Остается неясным, может ли фосфорилирование белков в бактериях также регулировать такие процессы, как репарация ДНК или репликация.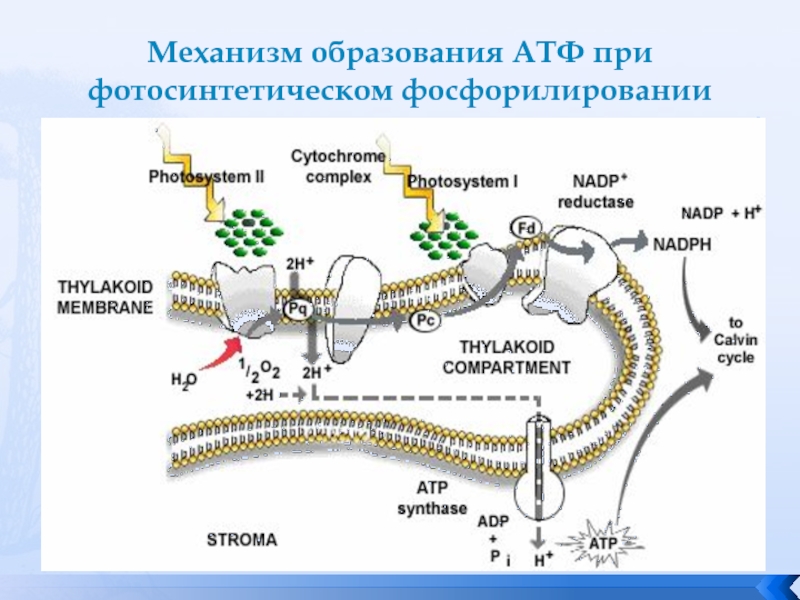
По сравнению с фосфорилированием белка прокариот, исследования фосфорилирования белка эукариот от дрожжей до клеток человека были довольно обширными. Известно, что эукариоты полагаются на фосфорилирование гидроксильной группы на боковых цепях серина, треонина и тирозина для передачи клеточных сигналов. Это основные регуляторные посттрансляционные модификации в эукариотических клетках, но фосфорилирование белков прокариот изучено менее интенсивно. В то время как серин, треонин и тирозин фосфорилируются у эукариот, гистидин и аспартат фосфорилируются у прокариот, растений и нерастительных эукариот. У бактерий фосфорилирование гистидина происходит в фосфоенолпируват-зависимых фосфотрансферазных системах (СТВ), которые участвуют в процессе интернализации, а также фосфорилирования сахаров.
Фосфорилирование белков протеинкиназой было впервые показано у E. coli и Salmonella typhimurium, но с тех пор оно было продемонстрировано на многих других бактериальных клетках.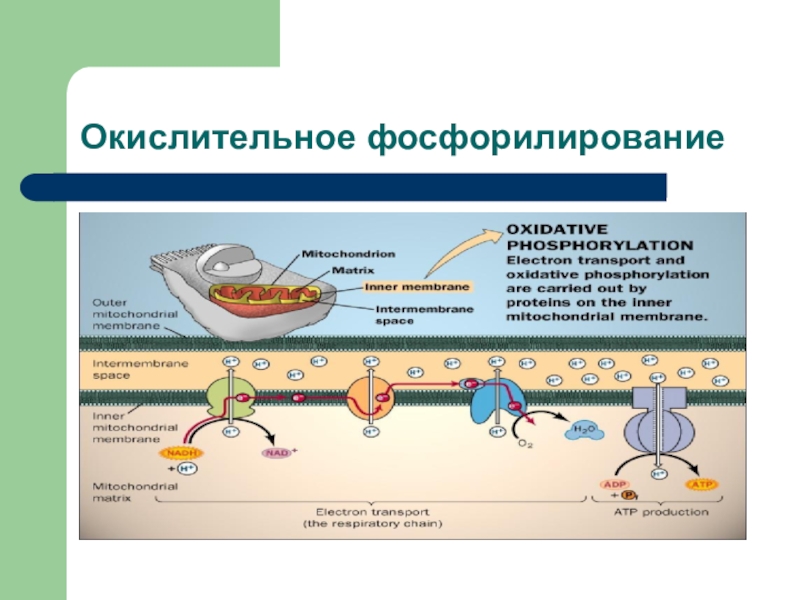 Было обнаружено, что бактерии используют фосфорилирование гистидина и аспартата в качестве модели для бактериальной сигнальной трансдукции, но в последние несколько лет появились доказательства того, что фосфорилирование серина, треонина и тирозина также присутствует в бактериях. Было показано, что бактерии несут киназы и фосфатазы, аналогичные их эукариотическим эквивалентам, но они также развили уникальные киназы и фосфатазы, которых нет у эукариот.
Было обнаружено, что бактерии используют фосфорилирование гистидина и аспартата в качестве модели для бактериальной сигнальной трансдукции, но в последние несколько лет появились доказательства того, что фосфорилирование серина, треонина и тирозина также присутствует в бактериях. Было показано, что бактерии несут киназы и фосфатазы, аналогичные их эукариотическим эквивалентам, но они также развили уникальные киназы и фосфатазы, которых нет у эукариот.
Патология
Аномальное фосфорилирование белков связано с рядом заболеваний, особенно с раком , но также с болезнью Альцгеймера , болезнью Паркинсона и другими дегенеративными расстройствами .
Белок тау принадлежит к группе белков, ассоциированных с микротрубочками (MAP), которые, среди прочего, помогают стабилизировать микротрубочки в клетках, включая нейроны. Ассоциативная и стабилизирующая активность тау-белка зависит от его фосфорилированного состояния. При болезни Альцгеймера из-за неправильной укладки и аномальных конформационных изменений в структуре тау-белка он оказывается неэффективным при связывании с микротрубочками и, таким образом, неспособен поддерживать структуру нервного цитоскелета в организованном состоянии во время нервных процессов; фактически аномальный тау-белок ингибирует и нарушает организацию микротрубочек и отключает нормальный тау-белок от микротрубочек в цитозольную фазу. Неправильная укладка приводит к аномальной агрегации в фибриллярные клубки внутри нейронов, что является признаком болезни Альцгеймера. Существует достаточное количество, которое необходимо фосфорилированию тау-белка для функционирования, но гиперфосфорилирование тау-белка считается одним из основных факторов, влияющих на его неспособность связываться. Фосфатазы PP1, PP2A, PP2B и PP2C дефосфорилируют тау-белок in vitro , и их активность, как было обнаружено, снижена в областях мозга у пациентов с болезнью Альцгеймера. Фосфопротеин тау-белка гиперфосфорилируется в три-четыре раза у пациента с болезнью Альцгеймера по сравнению с пожилым здоровым человеком. Тау-белок болезни Альцгеймера, по-видимому, удаляет MAP1 и MAP2 (два других основных ассоциированных белка) из микротрубочек, и этот вредный эффект отменяется, когда выполняется дефосфорилирование, что свидетельствует о гиперфосфорилировании как единственной причине разрушительной активности.
Неправильная укладка приводит к аномальной агрегации в фибриллярные клубки внутри нейронов, что является признаком болезни Альцгеймера. Существует достаточное количество, которое необходимо фосфорилированию тау-белка для функционирования, но гиперфосфорилирование тау-белка считается одним из основных факторов, влияющих на его неспособность связываться. Фосфатазы PP1, PP2A, PP2B и PP2C дефосфорилируют тау-белок in vitro , и их активность, как было обнаружено, снижена в областях мозга у пациентов с болезнью Альцгеймера. Фосфопротеин тау-белка гиперфосфорилируется в три-четыре раза у пациента с болезнью Альцгеймера по сравнению с пожилым здоровым человеком. Тау-белок болезни Альцгеймера, по-видимому, удаляет MAP1 и MAP2 (два других основных ассоциированных белка) из микротрубочек, и этот вредный эффект отменяется, когда выполняется дефосфорилирование, что свидетельствует о гиперфосфорилировании как единственной причине разрушительной активности.
болезнь Паркинсона
α-Синуклеин — это белок, связанный с болезнью Паркинсона.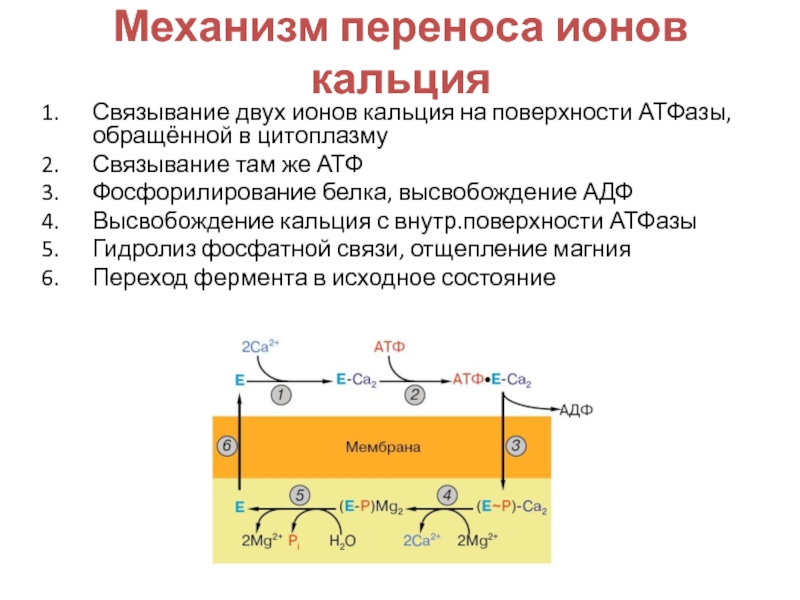 Этот белок кодируется геном PARRK1, и в своей нативной форме α-синуклеин участвует в рециркуляции синаптических пузырьков, которые несут нейротрансмиттеры, и в естественных условиях находится в развернутой форме. Повышенные уровни α-синуклеина обнаруживаются у пациентов с болезнью Паркинсона, и, по-видимому, существует положительная корреляция между количеством белка α-синуклеина, присутствующего у пациента, и тяжестью заболевания.
Этот белок кодируется геном PARRK1, и в своей нативной форме α-синуклеин участвует в рециркуляции синаптических пузырьков, которые несут нейротрансмиттеры, и в естественных условиях находится в развернутой форме. Повышенные уровни α-синуклеина обнаруживаются у пациентов с болезнью Паркинсона, и, по-видимому, существует положительная корреляция между количеством белка α-синуклеина, присутствующего у пациента, и тяжестью заболевания.
Фосфорилирование аминокислоты Ser 129 в белке α-синуклеина оказывает сильное влияние на тяжесть заболевания. По-видимому, существует корреляция между общей концентрацией альфа-синуклеина (нефосфорилированного) и тяжестью симптомов у пациентов с болезнью Паркинсона. У здоровых пациентов уровень нефосфорилированного α-синуклеина выше, чем у пациентов с болезнью Паркинсона. Более того, измерение изменений соотношения концентраций фосфорилированного α-синуклеина к нефосфорилированному α-синуклеину у пациента может быть потенциальным маркером прогрессирования заболевания.
Фосфорилирование Ser 129 связано с агрегацией белка и дальнейшим повреждением нервной системы. Кроме того, агрегация фосфорилированного α-синуклеина может быть усилена, если пресинаптический каркасный белок Sept4 присутствует в недостаточных количествах. Важно отметить, что прямое взаимодействие α-синуклеина с белком Sept4 ингибирует фосфорилирование Ser 129 . Обратите внимание, однако, что фосфорилирование Ser 129 может наблюдаться без агрегации синуклеина в условиях сверхэкспрессии.
Рекомендации
Белки фосфорилирование — Справочник химика 21
Известно несколько типов протеинкиназ, активируемых различными эффекторами. Субстраты протеинкиназ —огромное количество белков, фосфорилирование которых приводит к изменению их активности. Более того, обнаружены протеинфосфатазы, которые, осуществляя гидролиз фосфатной группы, возвращают белковую молекулу в исходное состояние. Во многих случаях мишенью действия киназ являются другие киназы, которые фосфорилируют фосфатазы, в свою очередь регулируя их функцию. Таким образом, регуляция метаболизма имеет каскадный характер. [c.318]
Таким образом, регуляция метаболизма имеет каскадный характер. [c.318] Модификации аминокислот в составе белка фосфорилирование, ацетилирование, ацили-рование, гамма-карбоксилирование, сульфа-тирование, миристилирование и пальмитои-лирование. [c.135]
Железо функционирует как основной переносчик электронов в биологических реакциях окисления — восстановления [231]. Ионы железа, и Fe +, и Fe +, присутствуют в человеческом организме и, действуя как переносчики электронов, постоянно переходят из одного состояния окисления в другое. Это можно проиллюстрировать на примере цитохромов . Ионы железа также служат для транспорта и хранения молекулярного кислорода — функция, необходимая для жизнедеятельности всех позвоночных животных. В этой системе работает только Ре(П) [Fe(111)-гемоглобин не участвует в переносе кислорода]. Чтобы удовлетворить потребности метаболических процессов в кислороде, большинство животных имеет жидкость, циркулирующую по телу эта жидкость и переносит кислород, поглощая его из внешнего источника, в митохондрии тканей. Здесь он необходим для дыхательной цепи, чтобы обеспечивать окислительное фосфорилирование и производство АТР. Одиако растворимость кислорода в воде слишком низка для поддержания дыхания у живых существ. Поэтому в состав крови обычно входят белки, которые обратимо связывают кислород. Эти белковые молекулы способствуют проникновению кислорода в мышцы (ткани), а также могут служить хранилищем кислорода. [c.359]
Здесь он необходим для дыхательной цепи, чтобы обеспечивать окислительное фосфорилирование и производство АТР. Одиако растворимость кислорода в воде слишком низка для поддержания дыхания у живых существ. Поэтому в состав крови обычно входят белки, которые обратимо связывают кислород. Эти белковые молекулы способствуют проникновению кислорода в мышцы (ткани), а также могут служить хранилищем кислорода. [c.359]
Широко распространенные комплексные соединения железа с порфиринами не являются единственными биологически активными соединениями этого металла. Важные биологические функции (перенос электронов, восстановление при фиксации СО2, восстановление при фиксации N2, окисление сукцината при окислительном фосфорилировании и др.) выполняют белки, содержащие железо, связанное с серой сера представлена или сульфгидрильной формой (цистеин), или так называемой лабильной серой (вероятно, 5 — или Н8 ), число атомов которой чаще всего равно числу атомов железа в молекуле белка. [c.366]
[c.366]
Фосфорилирование фермента не отражается на ферментативной активности при pH 8,0. Однако фосфорилирование белка оказывает влияние на аллостерические свойства фермента повышается чувствительность к ингибированию АТФ и цитратом, но снижается чувствительность к активирующему действию АМФ и фруктозо-2,6-дифосфата. Предполагают, что фосфорилирование индуцирует конформацион-ные изменения, способствующие смещению равновесия между двумя формами фермента активной и неактивной. При связывании АТФ в ингибиторном центре также происходит смещение равновесия в сторону неактивной конформационной формы фосфофруктокиназы. [c.238]
Гемоглобин и миоглобин —комплексы железопорфиринов с белками, выполняющие функцию фиксации и транспорта молекулярного кислорода в организмах животных. Цитохромы, имеющие аналогичную принципиальную структуру, выполняющие роль переносчика электрона в схемах фотосинтеза, дыхания, окислительного фосфорилирования и др.
 окислительно-восстановительных реакциях, найдены у всех животных, растений и микроорганизмов. Хлорофиллы — главные участники процессов фотосинтеза — содержатся в высших растениях, водорослях и фотосинтезирующих бактериях. [c.265]
окислительно-восстановительных реакциях, найдены у всех животных, растений и микроорганизмов. Хлорофиллы — главные участники процессов фотосинтеза — содержатся в высших растениях, водорослях и фотосинтезирующих бактериях. [c.265]Так как эффекты с АМР обычно непродолжительны, ясно, что клетка способна дефосфорилировать белки, фосфорилированные А-киназой. Отщепление фосфата катализируют две главные протеинфосфатазы, одна из которых сама регулируется циклическим АМР. Уровень фосфорилирования всегда будет зависеть от баланса между активностями киназ и фосфатаз [c.374]
Кроме выделения, накопления и транспорта веществ и удаления секреторных продуктов, в зоне аппарата Гольджи могут осуществляться многие метаболические процессы. Так, под действием аппарата Гольджи могут происходить модификация различных белков, фосфорилирование, ацилирование аминокислот. В растительных клетках удалось проследить участие аппарата Гольджи в образовании срединной пластинки и росте клеточных [c. 40]
40]
Упомянем также об обнаружении фосфорилированных под действием киназ аминокислот после кислотного гидролиза белков. В этом случае наиболее удобным оказался двумерный высоковольтный электрофорез на бумаге ( Whatman ЗММ ) при pH 3,5 и 1,9 [ linton et al., 1982]. [c.485]
Изучение большого числа протекающих в митохондриях процессов может быть успешно проведено как с изолированными органеллами в качестве источника фермента, так и с высокоочищенными препаратами соответствующих митохондриальных ферментов. Однако второй подход практически неприемлем для изучения реакций, непосредственно сопряженных с функционированием системы трансформации энергии в митохондриях. В первую очередь это относится к процессу окислительного фосфорилирования, который с высокой эффективностью протекает и может быть изучен либо в изолированных (интактных) митохондриях, либо в специальным образом полученных препаратах субмитохондриальных частиц. В этом случае также важно убедиться в том, что скорость изучаемой реакции линейно зависит от концентрации катализатора (от концентрации общего белка митохондрий или субмитохондриальных частиц). Измерение скорости окислительного фосфорилирования и термодинамической эффективности (отношение АДФ/О) традиционно проводится и предшествует изучению любых митохондриальных функций. [c.465]
Измерение скорости окислительного фосфорилирования и термодинамической эффективности (отношение АДФ/О) традиционно проводится и предшествует изучению любых митохондриальных функций. [c.465]
В настоящей работе предлагается изучить зависимость скорости окислительного фосфорилирования и степени сопряженности митохондрий печени крысы от концентрации белка и проанализировать причины ее отклонения от линейности. [c.465]
Проводят аналогичную серию опытов с различными концентрациями белка митохондрий, добавляя вместо разобщителя 200 мкМ АДФ. После превращения всей добавленной АДФ в АТФ и выхода в контролируемое состояние пробы заканчивают (анаэробиоз) добавлением АДФ или ДНФ. Полученные результаты представляют в виде графической зависимости скорости разобщенного дыхания (+ДНФ), скорости дыхания в состоянии 3 ( + АДФ), скорости фосфорилирования, отношения АДФ/О и ДК от концентрации белка митохондрий в пробе. [c.466]
Субстратами протеинкиназ являются разнообразные белки, фосфорилирование которых изменяет их активность. Например, активация протеинкиназы А со стороны цАМФ приводит к фосфорилированию гликогенсинтазы и гликогенфосфорилазы. При этом активность первого фермента подавляется, а второго усиливается (см. главу 10). Таким образом, появление в кровяном русле адреналина, активирующего аденилатциклазу миоци-тов, улучшает энергетическое обеспечение сокращений сердечной мышцы. [c.318]
Например, активация протеинкиназы А со стороны цАМФ приводит к фосфорилированию гликогенсинтазы и гликогенфосфорилазы. При этом активность первого фермента подавляется, а второго усиливается (см. главу 10). Таким образом, появление в кровяном русле адреналина, активирующего аденилатциклазу миоци-тов, улучшает энергетическое обеспечение сокращений сердечной мышцы. [c.318]
Процесс клеточного деления состоит из деления ядра (митоз) и слеоующего за ним деления цитоплазмы (цитокинез). Митоз начинается с профазы — переходного периода, когда расщепление центросомы приводит к образованию двух полюсов веретена, организующего в дальнейшем распределение ядерного материала. В это же время начало фазы М сопровождается заметным усилением фосфорилирования определенных белков. Видимо, в результате этого в митотической клетке создается необычайно динамичная система микротрубочек. После разрушения ядерной оболочки в прометафазе кинетохоры конденсированных хромосом могут захватываться и стабилизироваться группами микротрубочек, в большом числе отходящих от обоих полюсов веретена.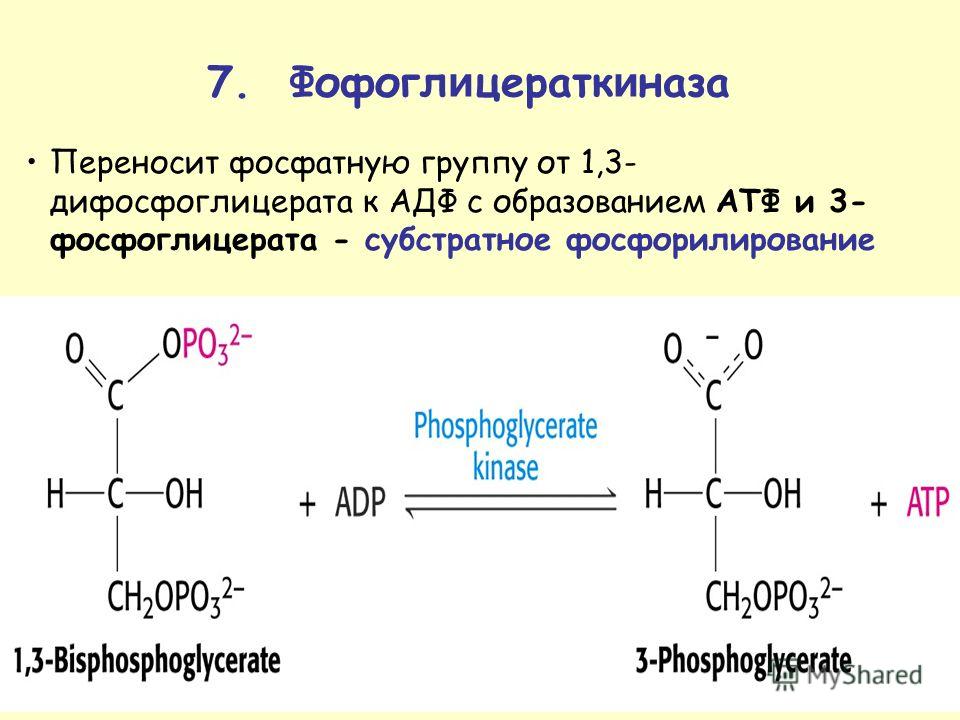 Эти микротрубочки тянут кинетохоры к противоположным полюсам, и в результате хромосомы располагаются во время метафазы по экватору веретена. В анафазе это натяжение внезапно ослабевает, когда сестринские хроматиды отделяются друг от друга и расходятся к разным полюсам. В добавление к этому часто раздвигаются и оба полюса. В конечной стадии митоза, телофазе, вокруг каждой группы разделившихся хромосом вновь формируется ядерная оболочка, когда белки, фосфорилированные в начале фазы М, вновь дефосфорилируются [c.467]
Эти микротрубочки тянут кинетохоры к противоположным полюсам, и в результате хромосомы располагаются во время метафазы по экватору веретена. В анафазе это натяжение внезапно ослабевает, когда сестринские хроматиды отделяются друг от друга и расходятся к разным полюсам. В добавление к этому часто раздвигаются и оба полюса. В конечной стадии митоза, телофазе, вокруг каждой группы разделившихся хромосом вновь формируется ядерная оболочка, когда белки, фосфорилированные в начале фазы М, вновь дефосфорилируются [c.467]
Эффекты сАМР обычно непродолжительны. Это означает, что клетки способны дефосфорилировать белки, фосфорилированные сАМР-зависимой про-теинкиназой. Эту обратную реакцию катализирует фосфопротеинфосфатаза-фермент, который сам находится под контролем с АМР. [c.273]
К. Неправильно. Кроме связывания с низкомолекулярными вешест-вами у эукариот есть и другие механизмы активации регуляторных белков, включая синтез белка, фосфорилирование и эффект регуляторных субъединиц. [c.410]
[c.410]
Осн. физиол. ф-ция А.-стимуляция биосинтеза и секреции стероидных гормонов корой надпочечников. Механизм действия включает специфич. связывание А. с рецепторами плазматич. мембраны клеток, стимуляцию в плазматич. мембране фермента аденилатциклазы, осуществляющей превращение АТФ в циклич. аденозинмонофосфат. Последний активирует в цитоплазме протеинкиназу, катализирующую серию р-ций фосфорилирования, в результате чего резко увеличивается скорость образования кортикостероидов, а также синтез специфич. белка, необходимого для стимуляции лимитирующей стадии синтеза стероидов — превращения холестерина в прегненолон. А. обладает также [c.37]
Действие сАМР в животных клетках основано на активации специфических клеточных ферментов, называемых сАМР-зависимыми протеинкиназами. Эти ферменты ката-тизируют перенос фосфата с АТР на определенные остатки серина или треонина небольшой группы клеточных белков. Фосфорилирование, в свою очередь, влияет на активность таких белков. Такие сАМР-зависимые протеинкиназы имеются во всех животных клетках. Видимо, они ответственны за все эффекты, вызываемые сАМР. Хотя во многих случаях белки-субстраты данных протеинкиназ неизвестны, однако в клетках разного типа они различны. Понятно, почему сАМР неодинаково влияет на разные клетки. Существует общее правило ферменты, фосфори- [c.63]
Такие сАМР-зависимые протеинкиназы имеются во всех животных клетках. Видимо, они ответственны за все эффекты, вызываемые сАМР. Хотя во многих случаях белки-субстраты данных протеинкиназ неизвестны, однако в клетках разного типа они различны. Понятно, почему сАМР неодинаково влияет на разные клетки. Существует общее правило ферменты, фосфори- [c.63]
Промотор гена глутаминсинтетазы замечателен не только те.м, что он регулируется с участием минорной сигма-субъединицы и нуклеотидных последовательностей, удаленных на большие расстояния от старта транскрипции, но и тем, что действие регуляторного белка. модулируется не путе.м связывания лигандов-эффекторов, которыми могли бы быть глута.мин или глутаминовая кислота, а путем хи.мической модификации — фосфорилирования и дефосфо-рилирования NR,,— осуществляемой несколькими ферментами, реагирующими на обеспеченность клетки источниками азота. [c.153]
Митохондрии (хондриосомы) имеют форму зернышек, палочек или нитей. Питательные вещества, проникающие в клетку, адсорбируются и аккумулируются хондриосомами и подвергаются быстрым превращениям вследствие концентрации в этих участках клетки соответствующих ферментов. В митохондриях полностью осуществляются цикл трикарбоновых кислот и важнейшая энергетическая реакция — окислительное фосфорилирование, почему их рассматривают как основную силовую станцию клетки. Здесь же происходят реакции активирования аминокислот в процессе синтеза белка, липидов и других соединений. [c.194]
Питательные вещества, проникающие в клетку, адсорбируются и аккумулируются хондриосомами и подвергаются быстрым превращениям вследствие концентрации в этих участках клетки соответствующих ферментов. В митохондриях полностью осуществляются цикл трикарбоновых кислот и важнейшая энергетическая реакция — окислительное фосфорилирование, почему их рассматривают как основную силовую станцию клетки. Здесь же происходят реакции активирования аминокислот в процессе синтеза белка, липидов и других соединений. [c.194]
Молекула киназы фосфорилазы состоит из субъединиц четырех типов ар б. Молекулярная масса фермента — 1,3-10 Да — отвечает формуле (аРуб)4- Киназа фосфорилазы играет, как показано, ключевую роль в регуляции обмена гликогена и в сопряжении гликогенолиза и мышечного сокращения. В скелетной мускулатуре она существует в двух молекулярных формах нефосфорилированной ( неактивированная ) и фосфорилированной ( активированная ). Первая активна лищь при pH 8,2, вторая — при pH 6,8 и 8,2. При активации фермента отнощение активностей, измеренных при pH 6,8/8,2, возрастает от 0,05 до 0,9—1,0. Активация киназы достигается фосфорилированием а- и р-субъединиц, которое катализирует цАМФ-зависимая протеинкиназа. Каталитическую роль выполняет -субъединица б-субъединица идентична a +- вязывaющeмy белку — кальмодулину. Ферментативная активность киназы фосфорилазы полностью зависит от ионов На р-субъединице фермента имеется регуляторный центр, обладающий высоким сродством к АДФ. Константа Михаэлиса для АТФ равна [c.223]
При активации фермента отнощение активностей, измеренных при pH 6,8/8,2, возрастает от 0,05 до 0,9—1,0. Активация киназы достигается фосфорилированием а- и р-субъединиц, которое катализирует цАМФ-зависимая протеинкиназа. Каталитическую роль выполняет -субъединица б-субъединица идентична a +- вязывaющeмy белку — кальмодулину. Ферментативная активность киназы фосфорилазы полностью зависит от ионов На р-субъединице фермента имеется регуляторный центр, обладающий высоким сродством к АДФ. Константа Михаэлиса для АТФ равна [c.223]
Величина АДФ/А (М/мин-мг белка) соответствует скорости фосфорилирования. Отношение скоростей У4 /У4 характеризует активность АТФ-гидролазных реакций митохондрий, регенерирующих АДФ после его фосфорилирования. [c.464]
Проводят три серии экспериментов по измерению окислительного фосфорилирования при различных концентрациях белка митохондрий в среде, содержащей дополнительно 100 мкМ ЭГТА (серия 1), 100 мкМ ЭГТА и 5 мкМ А23187 (серия 2) и 10 М рутениевый красный (серия 3). Параметры окислительного фосфорилирования рассчитывают и сравнивают с результатами проведенных ранее опытов. [c.466]
Параметры окислительного фосфорилирования рассчитывают и сравнивают с результатами проведенных ранее опытов. [c.466]
Основной путь разрушения тирозина в организме животных начинается реакцией переаминирования с превращением в п-оксифенилпи-руват (рис. 14-20, реакция в). Фермент тирозинаминотрансфераза изучен довольно подробно, что объясняется индукцией его синтеза в печени в ответ на действие глюкокортикоидных гормонов (гл. 11, разд. Е, 7). Синтез этого фермента контролируется и на уровне трансляции [119], причем освобождение новообразованного белка из рибосом печени стимулируется циклическим АМР. Кроме того, этот фермент подвержен постранскрипционной модификации, включающей фосфорилирование [120], и характеризуется необычно быстрым оборотом [121]. [c.145]
Гистон НЗ из тимуса теленка содержит 135 аминокислотных остатков [288], причем суммарный заряд первых 53 из них составляет -М8. Возможно, именно эта часть белка связывается с ДНК. В то же время карбоксильный конец этого гистона обладает гидрофобными свойствами и лишь в незначительной степени — основными. Интересные кластеры основных аминокислот были обнаружены в отдельных участках полипептидной цепи гистона Н2а [289]. Одна из любопытных особенностей строения гистонов — это наличие большого числа микромодификаций, сводящихся к фосфорилированию остатков серина, ацетилированию и метилированию остатков лизина, а также метилированию боковых цепей аргинина. Так, например, остатки Ьуз-14 и Ьуз-23 в гистоне НЗ К-ацетилированы, тогда как остатки Ьуз-9 и Ьуз-27 частично 8-Ы-метилированы — каждый участок содержит частично моно-, частично ди- и частично триметильные производные. [c.302]
В то же время карбоксильный конец этого гистона обладает гидрофобными свойствами и лишь в незначительной степени — основными. Интересные кластеры основных аминокислот были обнаружены в отдельных участках полипептидной цепи гистона Н2а [289]. Одна из любопытных особенностей строения гистонов — это наличие большого числа микромодификаций, сводящихся к фосфорилированию остатков серина, ацетилированию и метилированию остатков лизина, а также метилированию боковых цепей аргинина. Так, например, остатки Ьуз-14 и Ьуз-23 в гистоне НЗ К-ацетилированы, тогда как остатки Ьуз-9 и Ьуз-27 частично 8-Ы-метилированы — каждый участок содержит частично моно-, частично ди- и частично триметильные производные. [c.302]
К каиб. распространенным модификациям внутриклеточных белков относятся фосфорилирование и дефосфорилиро-вание по группе ОН остатков серина, тирозина и треонина, к-рые осуществляются с участием ферментов протеинкиназ и фосфатаз по схеме [c.103]
АТФ-аденозинтрифосфат, АДФ — аденозиндифосфат, Р-фосфорная к-та нли ее остаток Фосфорилирование сопровождается активацией или инактивацией ферментов, напр, гликозилтрансфераз, а также изменением физ. -хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует, напр., такие важные процессы, как транскрипция и трансляция, метаболизм липидов, глюконеогенез, мышечное сокращение. [c.103]
-хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует, напр., такие важные процессы, как транскрипция и трансляция, метаболизм липидов, глюконеогенез, мышечное сокращение. [c.103]
В механизме действия П. (как и мн. др. пептидно-белковых гормонов) на его начальном этапе принимают участие специфич. рецептор плазматич. мембраны клетки-мишени, аденилатциклаза, циклич. аденозинмонофосфат (цАМФ) и протеинкиназа. Активация аденилатциклазы (при воздействии П. на рецептор) приводит к образованию внутри клеток цАМФ, к-рый активирует фермент протеинкиназу, осуществляющую фосфорилирование функционально важных белков, и таким образом запускает ряд биохим. р-ций, обусловливающих в конечном счете физиол. эффект гормона. [c.446]
Обратимое фосфорилирование белков ССК II
Обратимое фосфорилирование белков ССК IIВ настоящее время изучен механизм быстрой регуляции переноса электрона за счет перераспределения энергии возбуждения между двумя ФС, основанный на обратимом фосфорилировании белков светособирающего комплекса (ССК). Дополнительный отрицательный заряд, получаемый основным полипептидом ССК при присоединение фосфатной группы специальной киназой, вызывает его латеральную миграцию из стыкованных областей мембраны тилакоида в нестыкованные, что переводит хлоропласт в состояние, когда повышается перенос энергии к ФС I и увеличивается вклад циклического фосфорилирования. В активировании киназы огромную роль играет редокс-состояние переносчиков электронов. Каталитическая часть киназы локализована в строме хлоропласта, а ее мембранная часть связана с цитохромным комплексом. Киназа не активна, пока пул хинонов окислен. После посадки дважды восстановленного хинона на цитохромный комплекс, он восстанавливает железо-серный комплекс Риске и цитохром f, вызывая одновременно конформационные изменения в макромолекуле цитохромного комплекса вблизи внутренней поверхности мембраны, передающиеся на мембранную часть киназы. Изменения ее конформации активирует фермент, который фосфорилирует треониновые остатки на белках ССК и ФС II.
Дополнительный отрицательный заряд, получаемый основным полипептидом ССК при присоединение фосфатной группы специальной киназой, вызывает его латеральную миграцию из стыкованных областей мембраны тилакоида в нестыкованные, что переводит хлоропласт в состояние, когда повышается перенос энергии к ФС I и увеличивается вклад циклического фосфорилирования. В активировании киназы огромную роль играет редокс-состояние переносчиков электронов. Каталитическая часть киназы локализована в строме хлоропласта, а ее мембранная часть связана с цитохромным комплексом. Киназа не активна, пока пул хинонов окислен. После посадки дважды восстановленного хинона на цитохромный комплекс, он восстанавливает железо-серный комплекс Риске и цитохром f, вызывая одновременно конформационные изменения в макромолекуле цитохромного комплекса вблизи внутренней поверхности мембраны, передающиеся на мембранную часть киназы. Изменения ее конформации активирует фермент, который фосфорилирует треониновые остатки на белках ССК и ФС II. Изменение активности фосфатазы также зависит от конформационных перестроек на внутренней поверхности цитохромного комплекса, т.к. в домене хлоропласта обнаружен циклофилин-подобный белок TLP 40, обладающий свойствами пептидил-пропил cis&trans-изомеразы и реагирующий на конформационные изменения цитохромного комплекса. На аминотерминальном конце белок имеет площадку, которая может быть местом связи с погруженным в домен концом фосфатазы. Пока цитохромный комплекс восстановлен, фосфатаза «заблокирована»; после его окисления фосфатаза активируется и дефосфорилирует фосфорилированные белки, в том числе и ССК. Потеряв дополнительный заряд, белок транспортируемого ССК диффундирует обратно и вновь ассоциируется с ФС II, увеличивая ее светопоглощение (сечение поглощения). Таким образом, происходит «подстройка» ЭТЦ, обеспечивающая оптимальное соотношение циклического и нециклического потока электронов и защиту ФС II от фотоокисления. Появление отрицательного заряда при фосфорилировании полипептидов ФС II может иметь и другие последствия.
Изменение активности фосфатазы также зависит от конформационных перестроек на внутренней поверхности цитохромного комплекса, т.к. в домене хлоропласта обнаружен циклофилин-подобный белок TLP 40, обладающий свойствами пептидил-пропил cis&trans-изомеразы и реагирующий на конформационные изменения цитохромного комплекса. На аминотерминальном конце белок имеет площадку, которая может быть местом связи с погруженным в домен концом фосфатазы. Пока цитохромный комплекс восстановлен, фосфатаза «заблокирована»; после его окисления фосфатаза активируется и дефосфорилирует фосфорилированные белки, в том числе и ССК. Потеряв дополнительный заряд, белок транспортируемого ССК диффундирует обратно и вновь ассоциируется с ФС II, увеличивая ее светопоглощение (сечение поглощения). Таким образом, происходит «подстройка» ЭТЦ, обеспечивающая оптимальное соотношение циклического и нециклического потока электронов и защиту ФС II от фотоокисления. Появление отрицательного заряда при фосфорилировании полипептидов ФС II может иметь и другие последствия.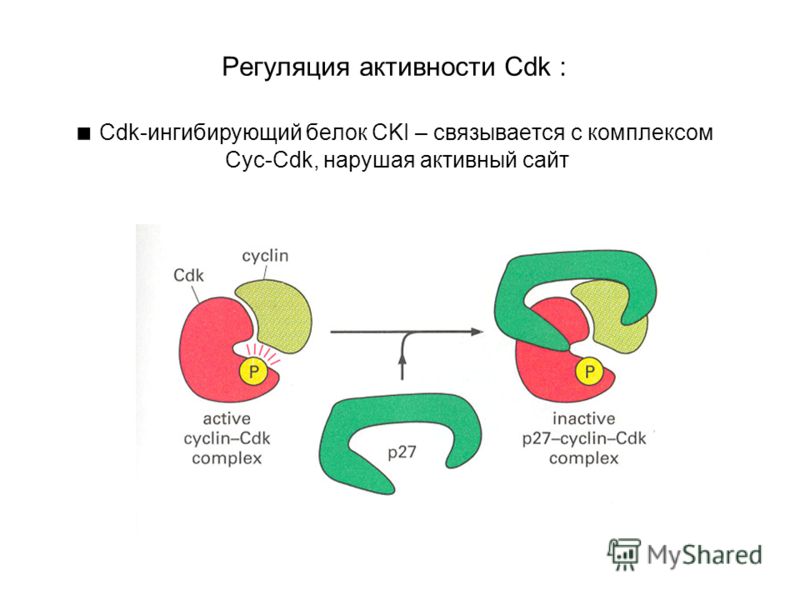 Так, оно может ослаблять связь QA с белком, приводя к потере QA и тем самым прерывать линейный электронный транспорт (Рубин,Чемерис, неопубликованные данные).
Так, оно может ослаблять связь QA с белком, приводя к потере QA и тем самым прерывать линейный электронный транспорт (Рубин,Чемерис, неопубликованные данные).
Наверх: Основные процессы в тилакоидной мембране
© 2004-2006 Кафедра биофизики Биологического факультета МГУ им. М.В. Ломоносова
– О системе
Адипокины: механизмы метаболических и поведенческих расстройств |
Введение
Метаболические и дегенеративные расстройства, ассоциированные с дисбалансом питания (сердечно-сосудистая патология, диабет, ожирение, депрессия и др.) – это самые распространенные заболевания в мире [1]. Такие заболевания всесторонне изучаются исследователями: пища, условия окружающей среды, генетика, фенотип (эпигенетика). Несмотря на проводимые исследования в данной области, частота ожирения и нарушений обмена веществ резко возрастает вслед за изменениями, происходящими в образе жизни и питании, особенно при диете с высоким содержанием фруктозы и жиров [2].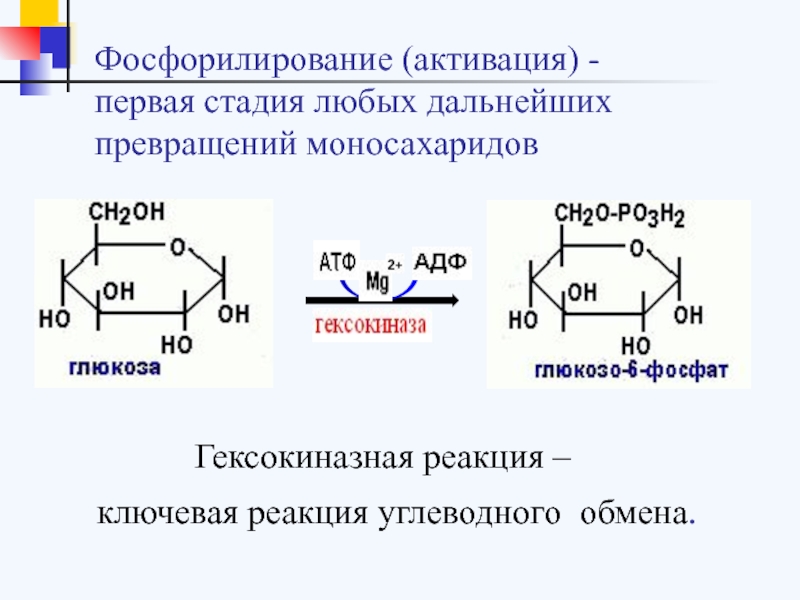 Эта эпидемия сопровождается когнитивными и аффективными расстройствами, оксидативным стрессом и повреждением ключевых ферментов в физиологическом гомеостазе.
Эта эпидемия сопровождается когнитивными и аффективными расстройствами, оксидативным стрессом и повреждением ключевых ферментов в физиологическом гомеостазе.
Высококалорийная диета и ожирение
Метаболизм фруктозы и липидов
Фруктоза – это простой моносахарид с высокой подслащивающей способностью, сравнимой с глюкозой и сахарозой. Потребление этого моносахарида значительно возросло за последнее десятилетие. Абсорбция фруктозы происходит при помощи специфических переносчиков GLUT5 (глюкозный транспортер тип 5) на апикальной мембране щеточной каемки энтероцитов и GLUT2 (глюкозный транспортер тип 2) в воротной вене [3]. Фруктоза практически полностью метаболизируется в печени с помощью фермента фруктокиназы [4]. Данный процесс протекает независимо от секреции инсулина [5]. В печени фруктоза быстро превращается в фосфотриозу (глицеральдегид-3-фосфат) независимо от наличия инсулина. Избыток фосфотриозы образует ацетил-КОА, который, в свою очередь, трансформируется в свободные жирные кислоты, этерифицирующиеся в триглицериды (ТГ) в клетках печени в процессе липогенеза [6, 7]. Данный процесс вызывает повышение уровня триглицеридов и ЛПОНП (липопротеидов низкой плотности) в плазме с развитием жирового гепатоза, нарушение толерантности к глюкозе, инсулинорезистентность и развитие гипертонии [8, 9].
Данный процесс вызывает повышение уровня триглицеридов и ЛПОНП (липопротеидов низкой плотности) в плазме с развитием жирового гепатоза, нарушение толерантности к глюкозе, инсулинорезистентность и развитие гипертонии [8, 9].
Высокое потребление жиров повышает плазменную концентрацию хиломикронов, содержащих неэтерифицированные жирные кислоты, в процессе катаболизма которых в мышцах вырабатывается аденозинтрифосфат (АТФ), в адипоцитах – ТГ [10], в печени – ЛПОНП и кетоны, что на фоне инсулинорезистентности часто приводит к развитию метаболического ацидоза [9].
На фоне сбалансированной диеты клеточный метаболизм контролирует соотношение АТФ/АМФ (аденозинмонофосфат) и НАДФН2+ (никотинамидадениндинуклеотидфосфат)/НАД+, таким образом контролируя обмен ферментов. Снижение этого соотношения вызывает активацию АМФК (протеинкиназа, активируемая АМФ) и сиртуинов: ключевых ферментов в регуляции некоторых физиологических процессов [11]. Основная роль AMФK заключается в фосфорилировании и ингибировании ГМГ-КoA-редуктазы (гидроксиметилглутарил-КoA-редуктазы) и ацетил-КоA-карбоксилазы, таким образом снижая уровень триглицеридов и интенсивность биосинтеза холестерина [12]. Несколько недавних исследований показали, что существует взаимосвязь между AMФK и сиртуинами, механизмом действия которых является дезацетилирование [13] Эти ферменты надолго связываются с несколькими факторами транскрипции (foxo3, PGC-1α, PPAR-α), активируя их. Это влечет за собой увеличение скорости таких процессов, как катаболизм, окисление глюкозы, образование митохондрий, которые часто нарушаются в ходе старения организма. Данные процессы нарушаются при высококалорийной диете, вызывая увеличение соотношения АТФ/АМФ и НАДФН2+/НАД+.
Несколько недавних исследований показали, что существует взаимосвязь между AMФK и сиртуинами, механизмом действия которых является дезацетилирование [13] Эти ферменты надолго связываются с несколькими факторами транскрипции (foxo3, PGC-1α, PPAR-α), активируя их. Это влечет за собой увеличение скорости таких процессов, как катаболизм, окисление глюкозы, образование митохондрий, которые часто нарушаются в ходе старения организма. Данные процессы нарушаются при высококалорийной диете, вызывая увеличение соотношения АТФ/АМФ и НАДФН2+/НАД+.
Накопление триглицеридов
ТГ синтезируются из жирных кислот и глицерол-3-фосфата. ТГ переносятся в форме ЛПОНП, если они поступили из печени, или хиломикронов, если они поступили в организм с пищей. Покидая печень, ЛПОНП переносят эндогенные триглицериды и холестерин, превращаясь в липопротеины промежуточной плотности (ЛПП) под воздействием ЛПЛ (липопротеинлипазы) и в липопротеины низкой плотности (ЛПНП) под воздействием печеночных липаз. ЛПНП и ЛПП связываются со специфическими рецепторами в периферии.
ЛПНП и ЛПП связываются со специфическими рецепторами в периферии.
Гидролиз ТГ, транспортирующихся в форме липопротеинов, осуществляется с помощью ЛПЛ, образуя глицерол и жирные кислоты. Несколько исследований показали, что ЛПЛ синтезируется на ранних стадиях дифференцировки адипоцитов, но активируется только в зрелых адипоцитах [14]. ЛПЛ связывается с поверхностью эндотелиальных клеток капилляров путем взаимодействия с гликозаминогликанами, а также с GPIHBP1 (гликофосфатидилинозитол якорный липопротеин высокой плотности, связывающий белок 1), который является связывающей молекулой [15].
В процессе гидролиза ТГ с помощью ЛПЛ высвобождаются жирные кислоты и глицерин, которые проникают в адипоциты, в то время как их избыток является основной характеристикой ожирения (рис. 1).
Рис. 1. Захват жирных кислот из хиломикронов и холестерина, полученных из липопротеинов очень низкой плотности (ЛПОНП/ VLDL).
(А) Схематическое изображение липогенеза из хиломикронов. Проникновение жирных кислот (ЖК/FA) в адипоциты обеспечивается липопротеиномсвязывающим белком 1 с высокой плотностью связывания с гликофосфатидилинозитолом (GPIHBP1), который является связывающей молекулой, и липопротеинлипазой (ЛПЛ/LPL), которая гидролизует триглицериды до жирных кислот (ЖК/FA).
Проникновение жирных кислот (ЖК/FA) в адипоциты обеспечивается липопротеиномсвязывающим белком 1 с высокой плотностью связывания с гликофосфатидилинозитолом (GPIHBP1), который является связывающей молекулой, и липопротеинлипазой (ЛПЛ/LPL), которая гидролизует триглицериды до жирных кислот (ЖК/FA).
(В) Схематическое изображение липогенеза из эндогенных липидов: под действием липопротеинлипазы (ЛПЛ/LPL) липопротеины очень низкой плотности (ЛПОНП/VLDL) трансформируются в липопротеины промежуточной плотности (ЛПП/IDL), которые, в свою очередь, трансформируются в липопротеины низкой плотности (ЛПНП/LDL) под действием печеночной липазы (ПЛ/LH), высвобождая холестерин; ЛПП (липопротеины промежуточной плотности) затем захватываются рецептором (B/E): B (аполипротеин типа B), E (аполипротеин типа E). Аполипопротеины представляют собой поверхностные белки ЛПОНП. За счет них производится перенос ЛПОНП в плазме и распознавание клетками.
Контроль липолиза
Запасы жировой ткани (ЖТ/AT) в основном мобилизуются во время голодания, физических нагрузок и различных стрессовых ситуаций (например, психологический стресс). ТГ жировой ткани гидролизуются с высвобождением глицерина и неэтерифицированных жирных кислот (НЭЖК/NEFA), которые поступают в плазму.
ТГ жировой ткани гидролизуются с высвобождением глицерина и неэтерифицированных жирных кислот (НЭЖК/NEFA), которые поступают в плазму.
НЭЖК, связываясь с альбумином плазмы, транспортируются к органам-мишеням (в частности, в скелетные мышцы, сердце, печень). Данный процесс является объектом мощного нейрогормонального контроля [16].
Липидная капля внутри адипоцита окружена различными белками [10], наиболее важный среди них – перилипин, который предотвращает липолиз в базальной среде, блокируя воздействие ЛПЛ на липидную каплю.
Три типа липаз участвуют в контроле гидролиза ТГ. Самой первой была обнаружена гормон-чувствительная липаза (ГЧЛ/HSL). Вторая липаза – адипоцитарная триглицеридная липаза (АТГЛ/ATGL) недавно была обнаружена тремя независимыми группами ученых. Данная липаза обладает исключительной активностью в гидролизе ТГ в ЖТ. Активность этих двух ферментов контролируется в определенном согласованном порядке. Третья липаза (липаза моноглицеридов – ЛМГ/LMG) широко распространенная в адипоцитах, гормонами не регулируется [17].
Активация липидов регулируется синергидными и взаимодополняющими механизмами. Она стимулируется катехоламинами (адреналином и норадреналином) и натрийуретическими пептидами и ингибируется инсулином [18]. Стимуляция бета-адренергических рецепторов активирует Гc(Gs)-белки (α-субъединицы высвобождают ГДФ и связывают ГТФ), диссоциация трех субъединиц может затем стимулировать различные клеточные взаимодействия, цАМФ, продуцируемый в ходе активации аденилилциклазы (АЦ), активирует протеинкиназу A (ПKA) (рис. 2), которая стимулирует фосфорилирование перилипинов, ГЧЛ и других белков-мишеней адипоцита. Натрийуретические пептиды стимулируют активность гуанилилциклазы (ГЦ) – рецептора натрийуретических пептидов, индуцируя увеличение уровней цГMф, активируя фосфорилирование протеинкиназы G (ПKG) и активируя ГЧЛ. Эта молекула гидролизует три- и диглицериды. Моноглицериды гидролизуются с помощью липазы моноглицеридов (ЛМГ).
Рис. 2. Контроль липолиза и липогенеза натрийуретическими пептидами, катехоламинами и инсулином: натрийуретические пептиды и катехоламины стимулируют липолиз, активируя гормон-чувствительную липазу (ГЧЛ/HSL), в то время как инсулин является мощным ингибитором липолиза, уменьшая активацию ГЧЛ.
НЭЖК (NEFA) – неэтерифицированные жирные кислоты; ПНП (ANP) – предсердный натрийуретический пептид; ТГЛА (TGLA) – триглицеридная липаза адипоцита; BНП (BNP) – натрийуретический пептид B-типа; ДГ (DG) – диглицериды; ГЦ (GC) – гуанилилциклаза; Ги-ГТФ – ингибиторы ГТФ-связывающего белка; Гс-ГТФ – стимуляторы ГТФ-связывающего белка; СРИ-1 (IRS-1) – субстрат рецептора инсулина-1; ГЧЛ (HSL) – чувствительная к гормонам липаза; МГ (MG) – моноглицериды; ФИЗ-К(PI3-K) – фосфатидилинозитол-3-киназа; ПKB/Akt (PKB/Akt) – белок AKT, ранее известный как ПKB – протеинкиназа B; ТГ (TG) – триглицериды.
Липолитическая активность адипоцитов человека находится под постоянным контролем пролиполитиков (бета-адренергических, натрийуретических пептидов) и антилиполитиков (инсулин, аденозин, простагландины, NPY (нейропептид Y) и альфа-адренергические пути) [19].
Полный гидролиз триглицеридов высвобождает неэтерифицированные жирные кислоты и глицерин. ГЧЛ способствует высвобождению неэтерифицированных ЖК путем простой диффузии, в то время как высвобождение глицерина стимулируется АП-7 (аквапорин-7). Инсулин через его рецепторы активирует сигнальный путь (IRS-1, PI3-K, PKB/Akt, который играет ключевую роль в мультиклеточных процессах, таких как метаболизм глюкозы и липидов), а также путь PDE-3B (фосфодиэстераза-3B), вызывающий распад цАМФ. Инсулин обладает антилиполитическим эффектом посредством контроля зависимого от цАМФ пути.
Инсулин через его рецепторы активирует сигнальный путь (IRS-1, PI3-K, PKB/Akt, который играет ключевую роль в мультиклеточных процессах, таких как метаболизм глюкозы и липидов), а также путь PDE-3B (фосфодиэстераза-3B), вызывающий распад цАМФ. Инсулин обладает антилиполитическим эффектом посредством контроля зависимого от цАМФ пути.
Жировая ткань и воспаление
ЖТ, долгое время считающаяся резервной, оказалась полноценным эндокринным органом. ЖК, а также клетки сосудистой стромы ЖТ участвуют в высвобождении молекул, обладающих аутокринными и паракринными эффектами [20]. Белая ЖТ представляет собой эндокринный орган с мощной способностью выделять большое количество белковых факторов – адипокинов [21].
Таким образом, адипоциты выделяют лептин и адипонектин, гормоны, участвующие в контроле гомеостаза энергии, а также воспалительные молекулы, такие как хемокины, белки острой фазы, включая С-реактивный белок, а также воспалительные цитокины, TNFα и IL-6. Было показано, что ЖТ вырабатывает большое количество белков, связанных с воспалением, но гены, кодирующие эти белки, преимущественно локализованы в стромально-сосудистой части, состоящей из клеток различных штаммов, включая преадипоциты, эндотелиальные клетки, а также макрофаги [22]. Накопление макрофагов в ЖТ зависит от активности продуцирования воспалительных цитокинов, что наблюдается при ожирении [22]. Следовательно, ЖТ является причиной развития ожирения за счет прогрессирующего воспаления и инфильтрации макрофагами [23]. На ранних стадиях ожирения адипоциты выделяют небольшие количества TNFα, которые стимулируют продуцирование моноцитарного хемоаттрактантного белка-1 (MCP-1) преадипоцитами [24]. Подобным образом эндотелиальные клетки способны секретировать MCP-1 в ответ на цитокины, что позволяет привлекать макрофаги в ЖТ. Более того, повышенная секреция лептина адипоцитами может также способствовать накоплению макрофагов, облегчая их проникновение в ЖТ посредством стимуляции ангиогенеза [25].
Накопление макрофагов в ЖТ зависит от активности продуцирования воспалительных цитокинов, что наблюдается при ожирении [22]. Следовательно, ЖТ является причиной развития ожирения за счет прогрессирующего воспаления и инфильтрации макрофагами [23]. На ранних стадиях ожирения адипоциты выделяют небольшие количества TNFα, которые стимулируют продуцирование моноцитарного хемоаттрактантного белка-1 (MCP-1) преадипоцитами [24]. Подобным образом эндотелиальные клетки способны секретировать MCP-1 в ответ на цитокины, что позволяет привлекать макрофаги в ЖТ. Более того, повышенная секреция лептина адипоцитами может также способствовать накоплению макрофагов, облегчая их проникновение в ЖТ посредством стимуляции ангиогенеза [25].
Высококалорийная диета и расстройства метаболизма
Повышенное потребление жиров и углеводов запускает липогенез за счет активации ацетил-КоА-карбоксилазы, которая превращает ацетил-КoA в малонил-КoA, из которого затем образуются жирные кислоты. Такое состояние сопровождается развитием стеатоза печени, что в сочетании с продукцией ФНО-α (TNF-α), по-видимому, становится главной причиной инсулинорезистентности, которая вторична по отношению к ожирению. При сниженной активности инсулина увеличивается экспрессия белка, связывающего тирозин (PTB), ингибирующего связывание IRS с инсулиновым рецептором [26].
Такое состояние сопровождается развитием стеатоза печени, что в сочетании с продукцией ФНО-α (TNF-α), по-видимому, становится главной причиной инсулинорезистентности, которая вторична по отношению к ожирению. При сниженной активности инсулина увеличивается экспрессия белка, связывающего тирозин (PTB), ингибирующего связывание IRS с инсулиновым рецептором [26].
Воспаление, вызванное привлеченными макрофагами, также увеличивает фосфорилирование IRS1 на сериновых остатках, тем самым блокируя действие инсулина [27]. TNF-α, экспрессия которого увеличивается в ЖТ у людей или животных с ожирением и инсулинорезистентностью, действует на рецептор TNFR1, активируя сфингомиелиназу, которая усиливает выработку PKC. Это соединение блокирует активацию IRS1, индуцируя фосфорилирование белка до сериновых остатков в эндотелиальных клетках и гепатоцитах (рис. 3) [28].
Рис. 3. Развитие инсулинорезистентности за счет адипокинов.
Вслед за накоплением триглицеридов, адипоциты и стромально-сосудистые клетки начинают продуцировать ФНО-α (TNF-α) (фактор некроза опухолей альфа), это активирует адипокиновую сфингомиелиназу, ответственную за активацию внутриклеточных белков, участвующих в снижении активации IRS (субстрат рецептора инсулина).
Рис. 4. Образование свободных радикалов в процессе клеточного дыхания: схематическое изображение образования свободных радикалов, избыточное производство NADH (никотинамидадениндинуклеотида) и FADh3 (флавинадениндинуклеотида) приводит к дисфункции комплексов I и III, что сопровождается чрезмерным высвобождением O2- (анион супероксида).
Гипертензия является основным фактором риска для большинства сердечно-сосудистых заболеваний. Недавно лептин был идентифицирован как гормон, который повышает тонус симпатической нервной системы, резистентность к лептину часто сопровождается гиперсимпатикотонией и увеличением активности системы ренин-ангиотензин-альдостерон [1]. Адреналин, связывающийся с альфа-1-рецепторами, активирует PLC, который усиливает выброс IP3 и PKC, что увеличивает кровяное давление, тот же эффект наблюдается, когда ангиотензин присоединяется к его АТ1-рецептору, связанному с альфа-1-субъединицей рецептора Gαq на плазматической мембране клеток гладкой мускулатуры [1].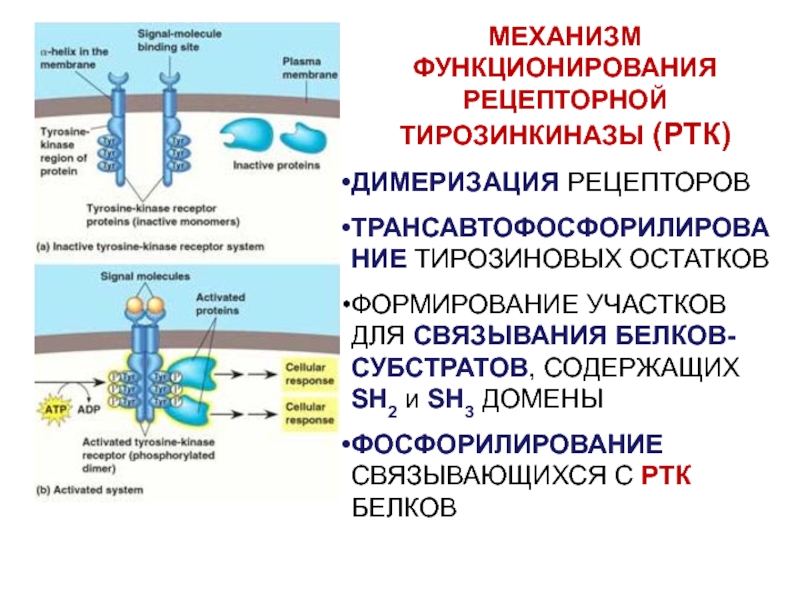 Для пациентов с ожирением гипертрофия левого желудочка является характерной и часто ассоциируется с застойной сердечной недостаточностью [29]. Висцеральная жировая ткань ассоциируется со значительным увеличением TГ (TGs) и пониженным уровнем ЛПВП, а также с увеличением ApoB и LDL [30]. В то время как низкоплотные частицы ЛПНП циркулируют дольше, легче проникают в мембрану эндотелиальной стенки и прилипают к молекулам адгезии, вызывая атеросклероз [31].
Для пациентов с ожирением гипертрофия левого желудочка является характерной и часто ассоциируется с застойной сердечной недостаточностью [29]. Висцеральная жировая ткань ассоциируется со значительным увеличением TГ (TGs) и пониженным уровнем ЛПВП, а также с увеличением ApoB и LDL [30]. В то время как низкоплотные частицы ЛПНП циркулируют дольше, легче проникают в мембрану эндотелиальной стенки и прилипают к молекулам адгезии, вызывая атеросклероз [31].
При таком расстройстве метаболизма изменяется экспрессия других ферментов, особенно АМФК (AMPK) и сиртуинов, увеличение образования АТФ и НАДФН+ уменьшает активность этих ферментов, что обусловлено низкой активностью PGC-1α, FOXO, следствием которой являются дисрегуляция гликемии и митохондриальная дисфункция с увеличением mTOR (мишени рапамицина млекопитающих), замедляющие реакции каскада инсулина [32].
Оксидативный стресс является одним из последствий гиперкалорийной диеты. В процессе клеточного катаболизма образуются переносчики, обогащенные протонной энергией: NADH’H+ и FADh3. Эти молекулы подвергаются окислительному фосфорилированию на внутренней мембране митохондрий с целью получения АТФ. Эти реакции сопровождаются образованием небольшого количества супероксидного аниона O2- [33].
Эти молекулы подвергаются окислительному фосфорилированию на внутренней мембране митохондрий с целью получения АТФ. Эти реакции сопровождаются образованием небольшого количества супероксидного аниона O2- [33].
Высококалорийная диета или накопление ацетил-КоА нарушают комплексы I и III дыхательной цепи посредством реакций, которые не очень хорошо изучены, ускоряя образование супероксидных анионов и увеличивая их количество в этих комплексах [34].
Образование O2- приводит к избыточному образованию АФК (ROS) (активных форм кислорода), наиболее известной из которых является пероксинитрит ONOO, который разрушает плазматическую мембрану путем перекисного окисления липидов, взаимодействуя с фосфолипидами жирных кислот [35]. Образование перекиси водорода h3O2 изменяет клеточный компартмент: ДНК и функцию митохондрий посредством реакции Фентона [33]: h3O2 + Fe2+ ==> OH + OH- + Fe3+. ROS являются основной причиной старения в соответствии с теорией свободных радикалов. Они нарушают обмен веществ и вызывают некоторые нейронные заболевания, такие как болезнь Паркинсона и болезнь Альцгеймера [35].
Диета с высоким содержанием калорий и поведенческие расстройства
Адипокины, моноамины и поведенческие расстройства
Исследования показали, что у людей с депрессией отмечены более высокая продукция провоспалительных цитокинов (TNF-α, IFN-γ, IL-6) и более низкая продукция противовоспалительных цитокинов (IL-4, IL-10) [36]. Аналогичным образом было показано, что лечение иммунотерапией IFN-α у пациентов с раком приводит к поведенческим изменениям, таким как тревога и депрессия [37]. Также вероятно, что гипоталамо-гипофизарная ось (HPA) может связывать ожирение, тревогу и депрессию, поскольку была продемонстрирована дефектная отрицательная обратная связь оси HPA [38]. Исследования в этой области показывают, что хроническая активация гипоталамо-гипофизарной оси вызвана резистентностью к глюкокортикоидам, возникающей в результате наличия нефункционального рецептора в гипофизе, также как хроническое воздействие глюкокортикоидов на гиппокамп и ПФК (префронтальную кору) вызывает атрофию этих структур мозга, что приводит к депрессии [39].
В случае ожирения, которое характеризуется хроническим воспалением, продуцируемые цитокины способствуют симпатической активности, которая, в свою очередь, способствует активации иммунной системы и высвобождению воспалительных цитокинов [40]. Эти молекулы нарушают моноаминергические и нейротрофические сигналы, приводя к изменениям в нейротрансмиссии серотонина [5-НТ), норадреналина (NE) и допамина (DA), а также снижают чувствительность центральных кортикостероидных рецепторов, что приводит к снижению обратной связи [40].
Молекулярные механизмы, приводящие к атрофии нейронов, многочисленны: глутамат и серотонин могут влиять на ростовые факторы BDNF, EGF и FGF, которые увеличивают образование дендритных шипов [41]. Цитокины влияют на эти нейротрофические факторы с помощью механизмов, которые еще предстоит изучить [38]. Кроме того, концентрации глюкокортикоидов, значительно возрастающие у людей с ожирением, способны снижать уровни триптофана, ингибируя синтез 5-НТ [42–43].
Адипокины, нейровоспаление и поведенческие расстройства
Белок IDO (индоламиндиоксигеназа) был обнаружен методом иммуногистохимии в гиппокампе у пациентов, которые получали инъекции цитокинов, таких как TNF-α и IFN-γ, или у пациентов с болезнью Альцгеймера [44]. Подавляющее большинство исследований механизмов активации IDO показывают, что IFN-γ как цитокин в основном отвечает за индукцию данного белка [45]. Однако последние данные свидетельствуют о вовлечении в этот процесс других воспалительных цитокинов, секретируемых жировой тканью и макрофагами.
Подавляющее большинство исследований механизмов активации IDO показывают, что IFN-γ как цитокин в основном отвечает за индукцию данного белка [45]. Однако последние данные свидетельствуют о вовлечении в этот процесс других воспалительных цитокинов, секретируемых жировой тканью и макрофагами.
Было отмечено, что активированный IDO, вероятно, способствует (через продукцию нейротоксических веществ, включая хинолиновую кислоту (QUIN)) гибели клеток при некоторых патологиях. Депрессия также может быть вызвана морфологическими и функциональными нарушениями мозга, которые могут возникнуть в результате активации IDO в результате воспаления [46]. Активированный IDO инициирует кинурениновый путь, который обладает нейротоксическим эффектом, особенно QUIN и 3-гидроксикинуренин (3OH-KYN), который тоже оказывает нейротоксическое действие, индуцируя окислительный стресс и смерть путем апоптоза (рис. 5B). Кроме того, 3OH-KYN увеличивает активность MAOs (моноаминоксидазы) и сам может участвовать в развитии расстройств настроения путем уменьшения количества 5-HT. Таким образом, QUIN и 3OH-KYN действуют через плохо изученные механизмы, вызывая повреждение нейронов [47].
Таким образом, QUIN и 3OH-KYN действуют через плохо изученные механизмы, вызывая повреждение нейронов [47].
Рис. 5. Роль адипокинов в развитии поведенческих расстройств: (А) схематическое изображение влияния инсулина и лептина на поведение. (B) Схематическое изображение влияния цитокинов на поведение.
Что касается ожирения, то некоторые предварительные данные исследований указывают на наличие защитных эффектов генетической делеции IDO на набор веса в результате высококалорийной диеты и на развитие стеатоза печени у грызунов [48]. В клинической практике применение селективных ингибиторов IDO и родственных ферментов для лечения ожирения и нарушений обмена веществ не исследовалось, однако недавно полученные данные свидетельствуют о том, что мультимодальные методы лечения, такие как средиземноморская диета, основанная на высоком потреблении оливкового масла холодного отжима, фруктов и злаков [49], и физические упражнения [50] могут повлиять на метаболизм триптофана путем повышения в плазме уровня TRY и снижения уровней вредных продуктов катаболизма триптофана, особенно KYN.
Воспалительные цитокины активируют фермент гуанозинтрифосфатциклогидролазу-1 (GTP-Ch2), являющийся лимитным для синтеза неоптерина. Эта активация индуцирует образование неоптерина за счет тетрагидробиоптерина (Bh5), кофактора тирозингидроксилазы, фермента, который необходим для синтеза катехоламинов, включая допамин. Снижение доступности Bh5 приводит к снижению синтеза дофамина. Активация GTPCh2 цитокинами, косвенно измеряемая увеличением производства неоптерина, таким образом, может повлиять на производство допамина, который участвует в регуляции настроения [51]. В соответствии с этими данными отмечены пониженные уровни Bh5 и увеличенные концентрации неоптерина в крови у пациентов с депрессивным расстройством. Важно отметить, что у пожилых людей хроническое воспаление низкой активности сопровождается активацией IDO и GTP-Ch2, что коррелирует с нейропсихиатрическими изменениями [52]. Кроме того, у пациентов с ожирением регистрировались высокие уровни неоптерина, из чего можно заключить, что активация GTP-Ch2 цитокинами в контексте ожирения и возникающие в результате изменения дофаминергической нейротрансмиссии могут способствовать развитию нейропсихиатрических симптомов, связанных с ожирением.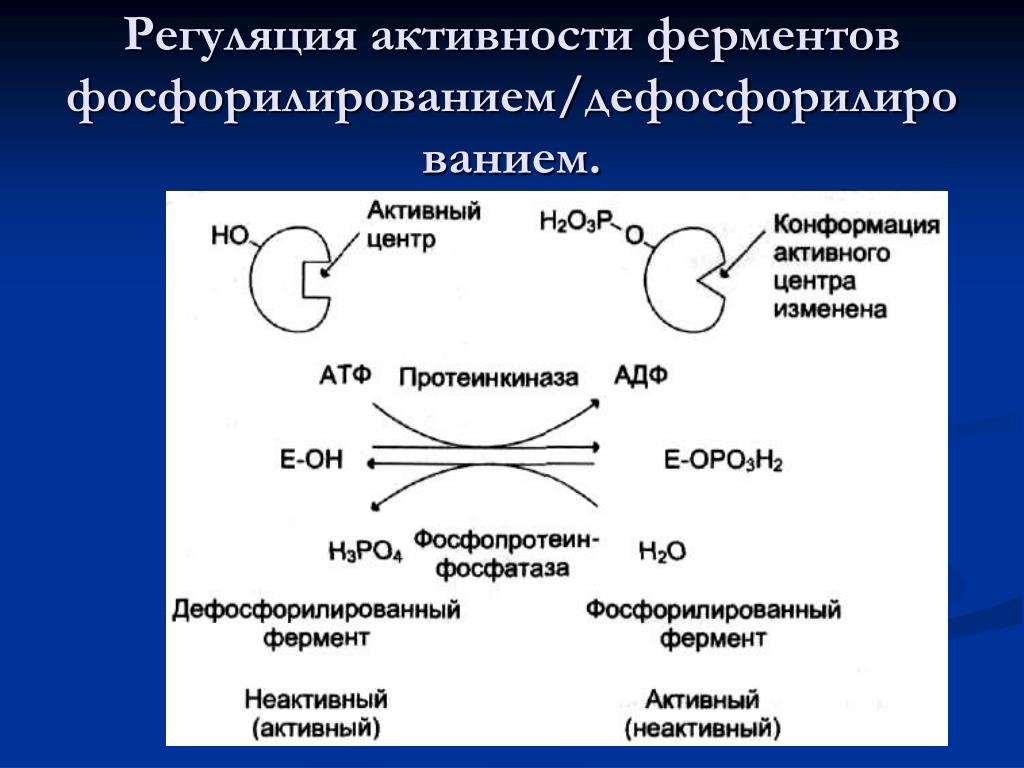
Инсулинорезистентность и поведенческие расстройства
Другая теория состоит в том, что ключевая роль в регуляции клеточного энергетического метаболизма может принадлежать гликогенсинтетазе киназе 3 (GSK-3). Как описано ранее, GSK-3 изначально изучался из-за его роли в фосфорилировании гликогенсинтетазы, действуя как важнейший регулятор эффектов инсулина на инсулин/PI3киназный/Akt-путь. Инактивация GSK-3 приводит к синтезу гликогена, активации рецептора инсулина путем снижения фосфорилирования IRS-1 и снижения фосфорилирования и активации GSK [53].
Нарушение метаболического профиля также связано с депрессией. Инсулинорезистентность повышает активность GSK-3, что неблагоприятно влияет на регуляцию клеточных функций на периферии и в гиппокампе [17]. Это часто приводит к биполярному расстройству, шизофрении и депрессии через β-катенин, который необходим для нейрогенеза и синаптогенеза [12], снижение экспрессии белка PKB/AKT часто наблюдается при резистентности к лептину и резистентности к инсулину (рис.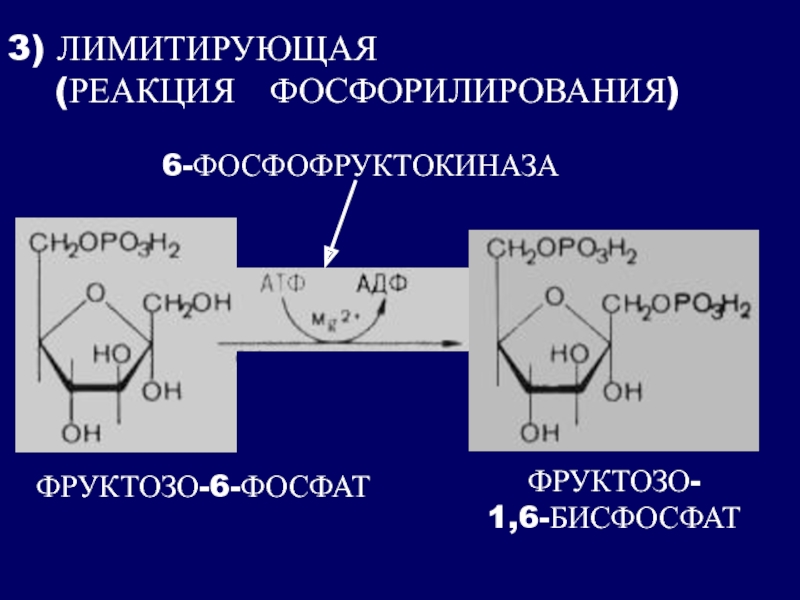 5A).
5A).
Существует другая молекула, которая играет очень важную роль на периферии и на центральном уровне, чья концентрация отрицательно коррелирует с резистентностью к инсулину. Адипонектин является наиболее значимым представителем противовоспалительных адипокинов [31]. Было показано, что эта молекула ингибирует передачу NFkB в эндотелиальных клетках, уменьшая воспаление, вызванное адипокинами [26]. Адипонектин действует через два рецепторных подтипа AdipoR1 и AdipoR2 и опосредует их действие преимущественно через аденозинмонофосфат-активированную протеинкиназу (AMPK) [53]. Интересно, что уровни адипонектина в плазме снижаются при ожирении [36]. В целом этот адипокин представляется перспективным кандидатом для лечения/снижения выраженности первичного хронического воспаления и вторичных сопутствующих состояний при ожирении [36].
1. Adams ST, Salhab M, Hussain ZI, et al.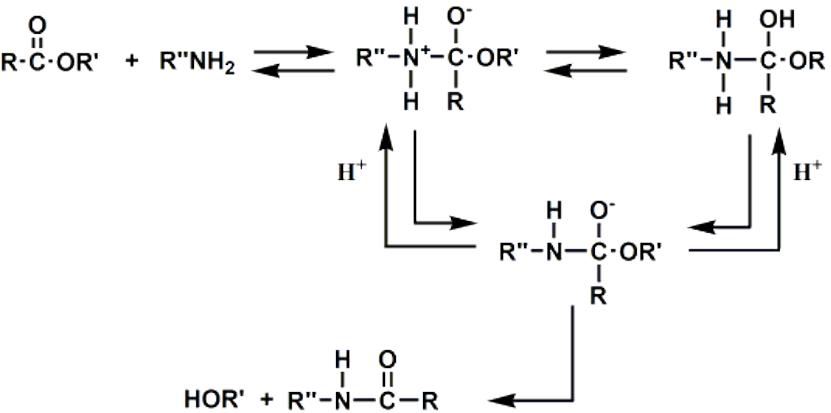 Obesity-related hypertension and its remission following gastric bypass surgery – A review of the mechanisms and predictive factors. Blood Press. 2012;22(3):131-137. doi: 10.3109/08037051.2012.749570.
Obesity-related hypertension and its remission following gastric bypass surgery – A review of the mechanisms and predictive factors. Blood Press. 2012;22(3):131-137. doi: 10.3109/08037051.2012.749570.
2. Andersen RE. The spread of the childhood obesity epidemic. CMAJ. 2000;163(11):1461-1462. PMC80413.
3. — Douard V, Ferraris RP. Regulation of the fructose transporter GLUT5 in health and disease. American Journal of Physiology-Endocrinology and Metabolism. 2008;295(2):E227-E237. doi: 10.1152/ajpendo.90245.2008.
4. Heinz F, Lamprecht W, Kirsch J. Enzymes of fructose metabolism in human liver. J. Clin. Invest. 1968;47(8):1826-1832. doi: 10.1172/jci105872.
5. Mayes PA. Intermediary metabolism of fructose. The American Journal of Clinical Nutrition. 1993;58(5):754S-765S. doi: 10.1093/ajcn/58.5.754S.
Mayes PA. Intermediary metabolism of fructose. The American Journal of Clinical Nutrition. 1993;58(5):754S-765S. doi: 10.1093/ajcn/58.5.754S.
6. Parks EJ, Skokan LE, Timlin MT, Dingfelder CS. Dietary Sugars Stimulate Fatty Acid Synthesis in Adults. The Journal of Nutrition. 2008;138(6):1039-1046. doi: 10.1093/jn/138.6.1039.
7. Basciano H, Federico L, Adeli K. Fructose, insulin resistance and metabolic dyslipidemia Nutr. Metab. 2005;2(1):5. doi: 10.1186/1743-7075-2-5.
8. Lê K-A, Tappy L. Metabolic effects of fructose. Curr. Opin. Clin. Nutr. Metab. Care. 2006;9(4):469-475. doi: 10.1097/01.mco.0000232910.61612.4d.
9. Havel PJ. Dietary fructose: implications for dysregulation of energy homeostasis and lipid/carbohydrate metabolism. Nutr. Rev. 2005;63(5):133-157.
Nutr. Rev. 2005;63(5):133-157.
10. Brasaemle DL. Thematic review series: Adipocyte Biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis. J. Lipid Res. 2007;48(12):2547-2559. doi: 10.1194/jlr.R700014-JLR200.
11. Foretz M, Carling D, Guichard C, et al. AMP-activated Protein Kinase Inhibits the Glucose-activated Expression of Fatty Acid Synthase Gene in Rat Hepatocytes. J. Biol. Chem. 1998;273(24):14767-14771. doi: 10.1074/jbc.273.24.14767.
12. Foretz M, Ancellin N, Andreelli F, et al. Short-Term Overexpression of a Constitutively Active Form of AMP-Activated Protein Kinase in the Liver Leads to Mild Hypoglycemia and Fatty Liver. Diabetes. 2005;54(5):1331-1339. doi: 10.2337/diabetes.54.5.1331.
doi: 10.2337/diabetes.54.5.1331.
13. Denu JM. Linking chromatin function with metabolic networks: Sir2 family of NAD+-dependent deacetylases. Trends Biochem. Sci. 2003;28(1):41-48. doi: 10.1016/s0968-0004(02)00005-1.
14. Lafontan M. Advances in adipose tissue metabolism. Int. J. Obes. 2009;32(S7):S39-S51. doi: 10.1038/ijo.2008.237.
15. Davies BSJ, Beigneux AP, Barnes RH, et al. GPIHBP1 Is Responsible for the Entry of Lipoprotein Lipase into Capillaries. Cell Metab. 2010;12(1):42-52. doi: 10.1016/j.cmet.2010.04.016.
16. Votruba SB, Jensen MD. Regional Fat Deposition as a Factor in FFA Metabolism. Annu. Rev. Nutr. 2007;27(1):149-163. doi: 10. 1146/annurev.nutr.27.061406.093754.
1146/annurev.nutr.27.061406.093754.
17. Lafontan M, Langin D. Lipolysis and lipid mobilization in human adipose tissue. Prog. Lipid Res. 2009;48(5):275-297. doi: 10.1016/j.plipres.2009.05.001.
18. Lafontan M, Moro C, Berlan M, et al. Control of lipolysis by natriuretic peptides and cyclic GMP. Trends Endocrinol. Metab. 2008;19(4):130-137. doi: 10.1016/j.tem.2007.11.006.
19. Stich V, De Glisezinski I, Crampes F, et al. Activation of α2-adrenergic receptors impairs exercise-induced lipolysis in SCAT of obese subjects. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2000;279(2):R499-R504. doi: 10.1152/ajpregu.2000.279.2.R499.
20. Ahima RS, Flier JS. Adipose tissue as an endocrine organ. Trends Endocrinol. Metab. 2000;11(8):327-332.
Ahima RS, Flier JS. Adipose tissue as an endocrine organ. Trends Endocrinol. Metab. 2000;11(8):327-332.
21. Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br. J. Nutr. 2007;92(03):347. doi: 10.1079/bjn20041213.
22. ClÉMent K, Viguerie N, Poitou C, et al. Weight loss regulates inflammation-related genes in white adipose tissue of obese subjects. The FASEB Journal. 2004;18(14):1657-1669. doi: 10.1096/fj.04-2204com.
23. Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue. J. Clin. Invest. 2003;112(12):1796-1808. doi: 10.1172/jci200319246.
24. Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J. Clin. Invest. 2003;112(12):1821-1830. doi: 10.1172/jci200319451.
Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J. Clin. Invest. 2003;112(12):1821-1830. doi: 10.1172/jci200319451.
25. Sierra-Honigmann MR, Nath AK, Murakami C, et al. Biological action of leptin as an angiogenic factor. Science. 1998;281(5383):1683-1686.
26. Imparl-Radosevich J, Deas S, Polansky MM, et al. Regulation of PTP-1 and Insulin Receptor Kinase by Fractions from Cinnamon: Implications for Cinnamon Regulation of Insulin Signalling. Horm. Res. Paediatr. 1998;50(3):177-182. doi: 10.1159/000023270.
27. Bandyopadhyay GK, Yu JG, Ofrecio J, Olefsky JM. Increased p85/55/50 Expression and Decreased Phosphotidylinositol 3-Kinase Activity in Insulin-Resistant Human Skeletal Muscle. Diabetes. 2005;54(8):2351-2359. doi: 10.2337/diabetes.54.8.2351.
Diabetes. 2005;54(8):2351-2359. doi: 10.2337/diabetes.54.8.2351.
28. Hotamisligil G kS, Peraldi P, Budavari A, et al. IRS-1-Mediated Inhibition of Insulin Receptor Tyrosine Kinase Activity in TNF-alpha- and Obesity-Induced Insulin Resistance. Science. 1996;271(5249):665-670. doi: 10.1126/science.271.5249.665.
29. Messerli FH. Cardiovascular effects of obesity and hypertension. Lancet. 1982;1(8282):1165-1168.
30. Grundy SM. Atherogenic dyslipidemia associated with metabolic syndrome and insulin resistance. Clin. Cornerstone. 2006;8 Suppl 1:S21-27.
31. Reaven GM. THE INSULIN RESISTANCE SYNDROME: Definition and Dietary Approaches to Treatment. Annu. Rev. Nutr. 2005;25(1):391-406. doi: 10.1146/annurev.nutr.24.012003.132155.
Annu. Rev. Nutr. 2005;25(1):391-406. doi: 10.1146/annurev.nutr.24.012003.132155.
32. Hardie DG. AMPK and Raptor: Matching Cell Growth to Energy Supply. Mol. Cell. 2008;30(3):263-265. doi: 10.1016/j.molcel.2008.04.012.
33. Halliwell B. Oxidative stress and neurodegeneration: where are we now? J. Neurochem. 2006;97(6):1634-1658. doi: 10.1111/j.1471-4159.2006.03907.x.
34. Balaban RS, Nemoto S, Finkel T. Mitochondria, Oxidants, and Aging. Cell. 2005;120(4):483-495. doi: 10.1016/j.cell.2005.02.001.
35. Lotharius J, Brundin P. Pathogenesis of parkinson’s disease: dopamine, vesicles and α-synuclein. Nature Reviews Neuroscience. 2002;3(12):932-942. doi: 10.1038/nrn983.
doi: 10.1038/nrn983.
36. Maes M, Song C, Lin A, et al. The effects of psychological stress on humans: increased production of pro-inflammatory cytokines and a Th2-like response in stress-induced anxiety. Cytokine. 1998;10(4):313-318.
37. Raison CL, Demetrashvili M, Capuron L, Miller AH. Neuropsychiatric adverse effects of interferon-alpha: recognition and management. CNS Drugs. 2005;19(2):105-123. PMC1255968.
38. Jessop DS, Dallman MF, Fleming D, Lightman SL. Resistance to Glucocorticoid Feedback in Obesity. J. Clin. Endocr. Metab. 2001;86(9):4109-4114. doi: 10.1210/jcem.86.9.7826.
39. Anacker C, Zunszain PA, Carvalho LA, Pariante CM. The glucocorticoid receptor: Pivot of depression and of antidepressant treatment? Psychoneuroendocrinology. 2011;36(3):415-425. doi: 10.1016/j.psyneuen.2010.03.007.
The glucocorticoid receptor: Pivot of depression and of antidepressant treatment? Psychoneuroendocrinology. 2011;36(3):415-425. doi: 10.1016/j.psyneuen.2010.03.007.
40. Raison CL, Capuron L, Miller AH. Cytokines sing the blues: inflammation and the pathogenesis of depression. Trends Immunol. 2006;27(1):24-31. doi: 10.1016/j.it.2005.11.006.
41. Pittenger C, Duman RS. Stress, Depression and Neuroplasticity: A Convergence of Mechanisms. Neuropsychopharmacology. 2007;33(1):88-109. doi: 10.1038/sj.npp.1301574.
42. Maes M, Schotte C, Scharpé S, et al. The effects of glucocorticoids on the availability of L-tryptophan and tyrosine in the plasma of depressed patients. J. Affect. Disord. 1990;18(2):121-127. doi: 10.1016/0165-0327(90)90068-j.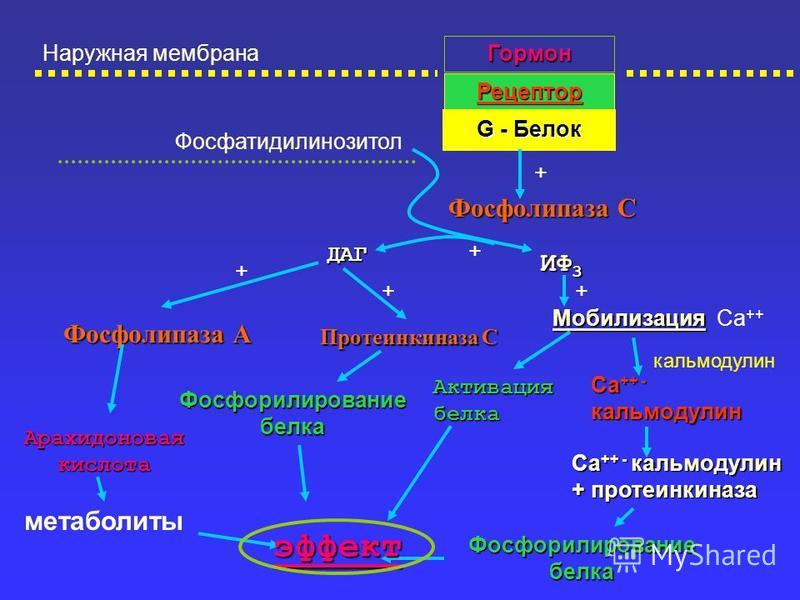
43. Markus CR, Olivier B, Panhuysen GEM, et al. The bovine protein α-lactalbumin increases the plasma ratio of tryptophan to the other large neutral amino acids, and in vulnerable subjects raises brain serotonin activity, reduces cortisol concentration, and improves mood under stress. The American Journal of Clinical Nutrition. 2000;71(6):1536-1544. doi: 10.1093/ajcn/71.6.1536.
44. Roy EJ, Takikawa O, Kranz DM, et al. Neuronal localization of indoleamine 2,3-dioxygenase in mice. Neurosci. Lett. 2005;387(2):95-99. doi: 10.1016/j.neulet.2005.07.010..
45. Guillemin GJ, Smythe G, Takikawa O, Brew BJ. Expression of indoleamine 2,3-dioxygenase and production of quinolinic acid by human microglia, astrocytes, and neurons. Glia. 2005;49(1):15-23. doi: 10.1002/glia.20090.
2005;49(1):15-23. doi: 10.1002/glia.20090.
46. Frenois F, Moreau M, O’Connor J, et al. Lipopolysaccharide induces delayed FosB/DeltaFosB immunostaining within the mouse extended amygdala, hippocampus and hypothalamus, that parallel the expression of depressive-like behavior. Psychoneuroendocrinology. 2007;32(5):516-531. doi: 10.1016/j.psyneuen.2007.03.005.
47. Stone TW, Darlington LG. Endogenous kynurenines as targets for drug discovery and development. Nature Reviews Drug Discovery. 2002;1(8):609-620. doi: 10.1038/nrd870.
48. Moyer BJ, Rojas IY, Kerley-Hamilton JS, et al. Inhibition of the aryl hydrocarbon receptor prevents Western diet-induced obesity. Model for AHR activation by kynurenine via oxidized-LDL, TLR2/4, TGFβ, and IDO1. Toxicol. Appl. Pharmacol. 2016;300:13-24. doi: 10.1016/j.taap.2016.03.011.
Toxicol. Appl. Pharmacol. 2016;300:13-24. doi: 10.1016/j.taap.2016.03.011.
49. Yu E, Ruiz-Canela M, Guasch-Ferré M, et al. Increases in Plasma Tryptophan Are Inversely Associated with Incident Cardiovascular Disease in the Prevención con Dieta Mediterránea (PREDIMED) Study. The Journal of Nutrition. 2017:jn241711. doi: 10.3945/jn.116.241711.
50. Mudry JM, Alm PS, Erhardt S, et al. Direct effects of exercise on kynurenine metabolism in people with normal glucose tolerance or type 2 diabetes. Diabetes Metab. Res. Rev. 2016;32(7):754-761. doi: 10.1002/dmrr.2798.
51. Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue. J. Clin. Invest. 2003;112(12):1796-1808. doi: 10.1172/jci200319246.
52. Eom T-Y, Jope RS. Blocked Inhibitory Serine-Phosphorylation of Glycogen Synthase Kinase-3α/β Impairs In Vivo Neural Precursor Cell Proliferation. Biol. Psychiatry. 2009;66(5):494-502. doi: 10.1016/j.biopsych.2009.04.015.
53. Kopelman PG. Obesity as a medical problem. Nature. 2000;404(6778):635-643. doi: 10.1038/35007508.
Группа физиологии цитоскелета | Институт белка РАН
Основные научные достижения
Исследования, ведущиеся в группе физиологии цитоскелета, сконцентрированы на решении проблем организации и динамики цитоскелета эукариот, в особенности микротрубочек. В работах группы показано, что в центросоме происходит удержание и стабилизация минус-концов микротрубочек, причем в этом процессе принимает участие микротрубочковый моторный белок динеин. В итоге этого процесса возникает радиальная организация микротрубочек в клетке. Продемонстрировано, что для формирования радиальной системы микротрубочек необходима активность протеинкиназы LOSK (SLK). Эта киназа была впервые описана в работах группы. Помимо радиальной организации микротрубочек на центросоме, протеинкиназа LOSK (SLK) также отвечает за поляризацию аппарата Гольджи на переднем крае ползущих по субстрату культивируемых фибробластов. Одним из субстратов LOSK (SLK) является ко-фактор динеина динактин, точнее, его большая субъединица белок p150Glued. Фосфорилирование динактина необходимо для его направления (таргетинга) на центросому. Это фосфорилирование не влияет на зависимое от динеина движение везикул в цитоплазме. Более того, фосфорилированию подвергается лишь небольшая часть p150Glued в фибробластах – его изоформа 1А, в основном представленная в нервной ткани. Другое направление работы группы — изучение роли микротрубочек и связанных с ними транспортных белков в динамике РНП-содержащих стрессовых гранул.
В итоге этого процесса возникает радиальная организация микротрубочек в клетке. Продемонстрировано, что для формирования радиальной системы микротрубочек необходима активность протеинкиназы LOSK (SLK). Эта киназа была впервые описана в работах группы. Помимо радиальной организации микротрубочек на центросоме, протеинкиназа LOSK (SLK) также отвечает за поляризацию аппарата Гольджи на переднем крае ползущих по субстрату культивируемых фибробластов. Одним из субстратов LOSK (SLK) является ко-фактор динеина динактин, точнее, его большая субъединица белок p150Glued. Фосфорилирование динактина необходимо для его направления (таргетинга) на центросому. Это фосфорилирование не влияет на зависимое от динеина движение везикул в цитоплазме. Более того, фосфорилированию подвергается лишь небольшая часть p150Glued в фибробластах – его изоформа 1А, в основном представленная в нервной ткани. Другое направление работы группы — изучение роли микротрубочек и связанных с ними транспортных белков в динамике РНП-содержащих стрессовых гранул. Выявлено, что образование и диссоциация стрессовых гранул зависят от микротрубочек, и что сами гранулы могут перемещаться по цитоплазме с помощью активного транспорта по микротрубочкам. В составе стрессовых гранул обнаружен динеин. Построена компьютерная симуляционная модель формирования стрессовых гранул и показано, что наиболее существенным фактором формирования стрессовых гранул является адгезивность компонентов стрессовых гранул друг к другу и возможность их одномерной диффузии по микротрубочкам. Показано, что фактор инициации трансляции eIF3, компонент стрессовых гранул, может связываться с микротрубочками клетки. Продемонстрировано также, что при действии гипертермии на клетки в них нарушаются все компоненты цитоскелета.
Выявлено, что образование и диссоциация стрессовых гранул зависят от микротрубочек, и что сами гранулы могут перемещаться по цитоплазме с помощью активного транспорта по микротрубочкам. В составе стрессовых гранул обнаружен динеин. Построена компьютерная симуляционная модель формирования стрессовых гранул и показано, что наиболее существенным фактором формирования стрессовых гранул является адгезивность компонентов стрессовых гранул друг к другу и возможность их одномерной диффузии по микротрубочкам. Показано, что фактор инициации трансляции eIF3, компонент стрессовых гранул, может связываться с микротрубочками клетки. Продемонстрировано также, что при действии гипертермии на клетки в них нарушаются все компоненты цитоскелета.
Перспективы исследований
В настоящее время в группе физиологии цитоскелета изучается роль аппарата Гольджи в организации клеточных микротрубочек и в регуляции движения фибробластов по субстрату. Кроме того, проводится исследование взаимодействия некоторых клеточных белков с микротрубочками in vitro, в частности, их одномерная диффузия вдоль микротрубочек и, в перспективе, организация микротрубочек вокруг искусственной центросомы – пластикового шарика с сорбированными на нем белками. Планируется исследование мутантных форм p150Glued, характерных для некоторых нейродегенеративных заболеваний, а также исследование микротрубочки-организующей способности центросомы в отдельных вариантах старения клеток.
Команда модельеров InSysBio создала инструмент для проверки «виновников» гиперфосфорилирования тау-белка как терапевтической мишени для лечения болезни Альцгеймера
26 февраля 2018
6 февраля 2018 года команда модельеров InSysBio опубликовала статью «A mathematical model of multisite phosphorylation of tau protein» в журнале PLOS ONE.
Биологический механизм болезни Альцгеймера до конца не ясен, основные гипотезы возникновения патологии нейронов связаны со скоплениями бета-амилоида и тау-белка. Математическое моделирование процессов, связанных с болезнью Альцгеймера – одно из основных направлений работы компании InSysBio. По этой теме за последние семь лет сотрудники InSysBio выпустили уже более десятка публикаций.
Тау-белок в норме стабилизирует архитектуру клетки. При таупатиях – в том числе, при болезни Альцгеймера – молекулы гиперфосфорилированного тау-белка агрегируют внутри нейронов в фибриллярные структуры, что приводит к гибели клеток. При этом фосфорилирование того или иного сайта тау-белка неравнозначно для патологических процессов, поэтому для поиска наиболее эффективной лекарственной мишени, а также маркеров для мониторинга развития патологии полезно представлять относительный вклад каждой из киназ и фосфатаз в фосфорилирование каждого из потенциальных сайтов – это и стало целью опубликованной работы.
Если белок потенциально фосфорилируется по n сайтам, то возникает 2n возможных состояний фосфорилирования. В рамках разработанного подхода авторам удалось описать фосфорилирование остатков по двум механизмам – последовательному и случайному – избежав при этом возникающую проблему комбинаторного взрыва.
На основании данных из множества (де)фосфорилирующих тау-белок ферментов были выбраны четыре киназы – GSK3β, PKA, CDK5, и p38γ и одна фосфатаза – PP2A, как наиболее изученные и перспективные мишени для потенциальных лекарств, а из нескольких десятков сайтов фосфорилирования – десять аминокислотных остатков. Для большей точности авторы включили в модель «псевдоостаток», который имитировал оставшиеся потенциальные сайты фосфорилирования.
Авторы разработали первую математическую модель мультисайтного фосфорилирования тау-белка. Впервые для оценки чувствительности состояния белка к ключевым ферментам удалось использовать реальные кинетические данные.
«Мы сделали первый шаг в понимании паттернов (де)фосфорилирования каждым из ферментов отдельных аминокислотных остатков тау-белка. Наша модель может подсказать, какую роль каждая киназа/фосфатаза играет в патогенезе таупатий и какими могут быть наиболее важные мишени для их терапии» – пояснил ведущий автор модели Александр Степанов.
«Эта модель – ещё один элемент интегрированной системно-фармакологической модели, разработкой которой занимается InSysBio, и которая может помочь в поиске лекарства от болезни Альцгеймера» – отметила Татьяна Карелина, к.ф.-м.н., руководитель направления моделирования нейродегенеративных заболеваний в InSysBio.
Об InSysBio
InSysBio – первая в Россия компания, которая специализируется в области Quantitative Systems Pharmacology (QSP). QSP-моделирование – подход, который использует математическое моделирование для описания и анализа биологических процессов, связанных с патогенезом заболеваний, и фармакологических свойств лекарственных препаратов. В течение последнего десятилетия фармацевтические компании стали использовать QSP-моделирование для принятия решений на ключевых этапах разработки лекарств. С 2004 года компания InSysBio осуществила более ста проектов в сотрудничестве с мировыми лидерами фармацевтической индустрии. Для более подробной информации об InSysBio, а также предоставляемых продуктах и услугах посетите сайт www.insysbio.com.
АНАЛИЗ КАНЦЕРОГЕННОГО ПОТЕНЦИАЛА HELICOBACTER PYLORI НА ОСНОВАНИИ ОПРЕДЕЛЕНИЯ СТЕПЕНИ ФОСФОРИЛИРОВАНИЯ CagA-БЕЛКА БАКТЕРИИ | Воропаев
1. Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori Infection. Clin Microbiol Rev. 2006;19(3):449-90. doi: 10.1128/CMR.00054-05.
2. Wroblewski LE, Peek RM, Wilson KT. Helicobacter pylori and gastric cancer: factors that modulate disease risk. Clin Microbiol Rev. 2010;23(4):713-39. doi: 10.1128/CMR.00011-10.
3. Wang AY, Peura DA. The prevalence and incidence of Helicobacter pylori-associated peptic ulcer disease and upper gastrointestinal bleeding throughout the world. Gastrointest Endosc Clin N Am. 2011;21(4):613-35. doi: 10.1016/j.giec.2011.07.011.
4. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55(2):74-108.
5. Warren JR. Gastric pathology associated with Helicobacter pylori. Gastroenterol Clin North Am. 2000;29(3):705-51.
6. Noto JM, Peek RM. Helicobacter pylori: an overview. Methods Mol Biol Clifton NJ. 2012;921:7-10. doi: 10.1007/978-1-62703-005-2_2.
7. Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol. 2012;4(7):156-69. doi: 10.4251/wjgo.v4.i7.156.
8. Климанская ЕВ, Возжаева ФС, Новикова АВ. Клинико-эпидемиологическое наблюдение при хроническом гастродуодените у детей, проживающих в условиях мегаполиса. Рос Журн Гастроэнтерологии Гепатологии и Колопроктологии. 1997; VII(5, приложение 4):30.
9. Мараховский КЮ, Мараховский ЮХ. Гастродуоденальная патология, ассоциированная с Helicobacter pylori, в детском возрасте. Рос Журн Гастроэнтерологии Гепатологии и Колопроктологии. 1997;VII(3):62-3.
10. Жебрун АБ. Инфекция Helicobacter pylori-глобальная проблема здравоохранения. Биосфера. 2015;7(2):227-37.
11. Müller A. Multistep activation of the Helicobacter pylori effector CagA. J Clin Invest. 2012;122(4):1192-5. doi: 10.1172/JCI61578.
12. Boyanova L. Role of Helicobacter pylori virulence factors for iron acquisition from gastric epithelial cells of the host and impact on bacterial colonization. Future Microbiol. 2011;6(8):843-6. doi: 10.2217/fmb.11.75.
13. Chang C-C, Kuo W-S, Chen Y-C, Perng C-L, Lin H-J, Ou Y-H. Fragmentation of CagA Reduces Hummingbird Phenotype Induction by Helicobactor pylori. PLoS ONE. 2016;2;11(3). [cited 15 Nov 2018] Available from: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC4775065/.
14. Fischer W, Prassl S, Haas R. Virulence mechanisms and persistence strategies of the human gastric pathogen Helicobacter pylori. Curr Top Microbiol Immunol. 2009;337:129-71. doi: 10.1007/978-3-642-01846-6_5.
15. Batista SA, Rocha GA, Rocha AM, Saraiva IE, Cabral MM, Oliveira RC, et al. Higher number of Helicobacter pylori CagA EPIYA C phosphorylation sites increases the risk of gastric cancer, but not duodenal ulcer. BMC Microbiol. 2011 Mar 24;11:61. doi: 10.1186/1471-2180-11-61.
16. Vilar e Silva A, Junior MR da S, Vinagre RMDF, Santos KN, da Costa RAA, Fecury AA, et al. Evaluation of the Pattern of EPIYA Motifs in the Helicobacter pylori cagA Gene of Patients with Gastritis and Gastric Adenocarcinoma from the Brazilian Amazon Region. Int J Bacteriol. 2014;2014:1-6. doi: 10.1155/2014/418063.
17. Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007;133(2):659-72. doi: 10.1053/j.gastro.2007.06.026.
18. Hatakeyama M. Structure and function of Helicobacter pylori CagA, the first-identified bacterial protein involved in human cancer. Proc Jpn Acad Ser B Phys Biol Sci. 2017;93(4):196-219. doi: 10.2183/pjab.93.013
Фосфорилирование белков — обзор
1 Введение
Фосфорилирование белков — это посттрансляционная модификация (ПТМ), состоящая из добавления фосфатных групп к определенным аминокислотным остаткам на белках. Этот PTM может изменять стабильность, субклеточное расположение и ферментативную активность белков, выполняющих различные роли в клетках. Фосфорилирование белков катализируется ферментами, известными как протеинкиназы, тогда как обратная реакция (то есть удаление фосфатов из белков) опосредуется протеинфосфатазами (Manning, Whyte, Martinez, Hunter, & Sudarsanam, 2002).У млекопитающих фосфорилирование в основном происходит по остаткам серина, треонина или тирозина, хотя также сообщалось о фосфорилировании гистидина (Steeg, Palmieri, Ouatas, & Salerno, 2003).
Сигналы, исходящие из внеклеточного пространства, а также метаболические или стрессовые сигналы, которые возникают внутри клетки, модулируют сигнальные потоки, управляются активностью киназ и фосфатаз. Таким образом, фосфорилирование белков является ключевым механизмом, с помощью которого клетки воспринимают окружающую среду (т.е. комбинация гормонов, факторов роста, цитокинов и питательных веществ) и внутреннего метаболического статуса, так что отдельные клетки могут управлять соответствующей физиологической реакцией в контексте ткани, в которой они находятся (Cohen, 1982).
Процессы, регулируемые фосфорилированием белков, включают биоэнергетический метаболизм, развитие клеточного цикла, транскрипцию, трансляцию, эндоцитоз, фагоцитоз и апоптоз. Кроме того, нарушение регуляции фосфорилирования белков связано с заболеваниями, имеющими актуальное значение в развитых странах, включая диабет, нейродегенерацию, аутоиммунные заболевания и рак (Forlenza et al., 2011; Янку и др., 2012; Парментер и др., 2014; Самовский и др., 2015). Также считается, что определенные каскады киназ (например, те, что ниже инсулиноподобного фактора роста) опосредуют процесс старения (Harrison et al., 2009; Longo et al., 2015). Следовательно, разработка ингибиторов киназ в качестве лекарств от различных заболеваний является активной областью фармакологических исследований (Knapp et al., 2013; Workman, Al-Lazikani, & Clarke, 2013). Около 30 ингибиторов киназ уже одобрены FDA для лечения различных форм рака, и было подсчитано, что более 200 таких соединений находятся на разных стадиях клинической разработки (Cohen, Kim, & DeMatteo, в печати; Fabbro, 2015 ; Кнапп и др., 2013).
Границы | Роль фосфорилирования белков в регуляции клеточного цикла и ДНК-связанных процессов у бактерий
Введение
Во всех живых клетках многие клеточные процессы контролируются посредством обратимого фосфорилирования белков по серину, треонину и тирозину (Ser / Thr / Tyr), которое является результатом противоположного действия киназ и фосфатаз. В то время как роль Ser / Thr и Tyr -протеинкиназ (STYK) и фосфатаз в клеточной регуляции подробно описана у эукариот, сигнальная сеть Ser / Thr / Tyr у бактерий имеет более недавнюю историю (Hunter, 2000; Pereira et al., 2011; Дворкин, 2015; Калантари и др., 2015; Manuse et al., 2015). Анализ микробных геномов показал, что киназы Ser / Thr типа Хэнкса (eSTK) и фосфатазы (eSTP) также широко распространены у бактерий (Zhang et al., 2007; Zhu et al., 2014). Однако фосфорилирование Tyr прокариот осуществляется с помощью другого семейства ферментов, бактериальных тирозинкиназ или BY-киназ, которые не имеют структурной гомологии с эукариотическими STYK. Вместо этого BY-киназы обладают структурными особенностями, характерными для АТФаз P-петли.Было показано, что BY-киназы, а также eSTK регулируют события клеточного цикла, адаптацию клеток к сигналам окружающей среды и вирулентность у многих видов (Wright and Ulijasz, 2014; Zhu et al., 2014; Kalantari et al., 2015).
Фосфорилирование обеспечивает чувствительный и динамичный способ регулирования активности, стабильности, взаимодействия белков и субклеточной локализации. Глобальные регуляторы часто становятся мишенью более чем одной киназы, изменяя экспрессию многих генов. Фосфорилирование регулятора транскрипции переходного состояния AbrB Bacillus subtilis тремя Ser / Thr киназами, PrkC, PrkD и YabT, приводит к нарушению регуляции многочисленных генов-мишеней во время перехода от вегетативного к стационарному росту (Kobir et al., 2014). В патогенных бактериях человека Staphylococcus aureus фосфорилирование глобального регулятора MgrA также модулирует экспрессию генов зависимым от фазы роста образом (Truong-Bolduc et al., 2008). Добавляя локальный отрицательный заряд, фосфорилирование может положительно или отрицательно влиять на связывание ДНК транскрипционных факторов с их регуляторными последовательностями, таким образом участвуя в вызове клеточного ответа. Недавний пример позитивной регуляции, опосредованной фосфорилированием тирозина, иллюстрируется регулятором SalA, который претерпевает конформационные изменения при фосфорилировании по тирозину 327, что увеличивает его сродство связывания ДНК с регуляторными последовательностями scoC выше (Derouiche et al., 2015а). Напротив, фосфорилирование регулятора вирулентности SarA S. aureus по серину 75 в области связывания HTH-ДНК отрицательно модулирует его способность связывать ДНК, что приводит к негативной регуляции экспрессии генов (Didier et al., 2010).
Было также замечено, что модуляция путем фосфорилирования связывания ДНК транскрипционных факторов играет роль в регуляции хромосомной репликации. Двухкомпонентные регуляторы MtrA Mycobacterium tuberculosis и CtrA Caulobacter Crescentus являются иллюстративными примерами того, что фосфорилирование действует, чтобы временно ограничить доступ белка инициатора репликации DnaA к исходной последовательности ДНК или iC (Didier et al., 2010; Пини и др., 2015). Аналогичная стратегия была предложена для объяснения роли главного регулятора Spo0A в негативном контроле инициации репликации ДНК путем ингибирования DnaA-зависимого раскручивания дуплекса ДНК во время споруляции у Bacillus subtilis (Castilla-Llorente et al., 2006; Xenopoulos and Piggot , 2011; Boonstra et al., 2013). Следовательно, пользуясь преимуществом универсальности факторов транскрипции в сочетании с ограниченными временными рамками, в течение которых они контактируют со своей регуляторной последовательностью, бактериальные клетки развили многофункциональные регуляторные белки, способные действовать как в контроле экспрессии генов, так и в контроле инициации репликации.
Однако мало что известно о роли фосфорилирования в прямом регулировании ДНК-связывающей активности белков, участвующих в других ДНК-опосредованных процессах. Крупномасштабные исследования фосфопротеома были проведены на бактериях, охватывающих как грамотрицательные, так и грамположительные виды (Macek et al., 2007, 2008; Voisin et al., 2007; Soufi et al., 2008; Ravichandran et al., 2009; Prisic et al., 2010; Schmidl et al., 2010; Ge et al., 2011; Manteca et al., 2011; Misra et al., 2011; Bai, Ji, 2012; Elsholz et al., 2012; Esser et al., 2012; Hansen et al., 2013; Соарес и др., 2013; Ян и др., 2013; Кеннелли, 2014; Ортега и др., 2014; Равикумар и др., 2014; Nakedi et al., 2015; Pan et al., 2015). Эти базы данных выявляют все большее количество бактериальных белков, фосфорилированных по Ser / Thr / Tyr, участвующих во множестве клеточных процессов, связанных с метаболизмом ДНК (Pan et al., 2015). Недавно сеть белок-белковых взаимодействий (PPI), сосредоточенная на B. subtilis S / T / Y протеинкиназ и фосфатаз, стала мощным инструментом в исследованиях бактериальной трансдукции сигнала, подчеркивая существование многих регуляторных путей, контролируемых фосфорилированием во время ДНК. репликация, хромосомная сегрегация и цитокинез (Shi et al., 2014б). Как и в случае с факторами транскрипции, мы можем ожидать, что фосфорилирование может модулировать свойства связывания белков с ДНК, а также с другими белками. Следовательно, сейчас большая проблема состоит в том, чтобы понять роль фосфорилирования белков в координации и интеграции различных процессов ДНК во время бактериального клеточного цикла. В этом обзоре мы сосредоточимся на новых аспектах регуляции у бактерий, которые напоминают те, которые имеют место у эукариот. Мы выделим растущее количество доказательств фосфорилирования белков, участвующих во многих связанных с ДНК процессах, и существования белков каркаса, которые действуют как интеграторы сигналов, облегчая взаимодействие и совместную локализацию киназ и их мишеней.
Идентификация фосфобелков, участвующих в ДНК-связанных процессах у бактерий
В живых клетках геном постоянно подвергается воздействию эндогенных и экзогенных повреждающих агентов. Если не восстановить, репликация поврежденных хромосом может вызвать остановку вилки или коллапс и последующую нестабильность генома и, возможно, гибель клеток (De Septenville et al., 2012; Merrikh et al., 2012; Cortez, 2015; Dungrawala et al., 2015) . Следовательно, для обеспечения целостности хромосом необходимо обнаружение и восстановление повреждений ДНК.При обнаружении повреждения эукариотические клетки передают информацию через каскады передачи сигналов для координации биологической реакции, включая остановку клеточного цикла и пути репарации ДНК (Iyer and Rhind, 2013). Эти сигнальные каскады обычно включают последовательную активацию протеинкиназ, перемежаемую фосфорилированием белков-эффекторов контрольной точки повреждения ДНК и процессинга (Subramanian and Hochwagen, 2014). Эти контрольные точки включают сенсорные белки, которые идентифицируют связанные с ДНК нарушения, превращая их в события фосфорилирования, которые модулируют функции определенных белков-мишеней.У эукариот эволюционно консервативные ATM (мутированные при атаксии-телеангиэктазии) и ATR (ATM и Rad 3-связанные) Ser / Thr киназы считаются парадигмой для таких каскадов трансдукции (Cimprich and Cortez, 2008). Эти два главных регулятора действуют в ответ на двухцепочечные разрывы (ATM), а также в контроле инициации репликации и репарации поврежденных вилок (ATR) для координации клеточного цикла, репарации и репликации (Shechter et al., 2004a, b; Cimprich и Cortez, 2008; Lee et al., 2015).
У большинства бактерий репликация кольцевой хромосомы требует скоординированного действия консервативных белков для выполнения стадий инициации, удлинения и терминации (Langston and O’Donnell, 2006; Langston et al., 2009). Инициация опосредуется белком инициатора репликации DnaA, который связывается со специфическими исходными последовательностями. Это формирует нуклеопротеиновую структуру, ведущую к раскручиванию дуплекса ДНК для последующей загрузки репликационного аппарата или реплисомы. Бактериальная реплисома обычно состоит из ДНК-полимеразы III типа, ДНК-геликазы и скользящего зажима с ассоциированным белковым комплексом, загружающим зажим. Во время удлинения репликационная фабрика сталкивается с многочисленными препятствиями или повреждениями, которые могут вызвать остановку вилки (Pomerantz and O’Donnell, 2010; Mettrick and Grainge, 2015).Как и у эукариот, необходимы механизмы для восстановления и / или перезапуска продолжающейся репликационной вилки для сохранения целостности генома (Merrikh et al., 2012). У всех живых организмов репликация хромосом должна координироваться с другими клеточными путями (Sclafani and Holzen, 2007).
У бактерий, однако, еще предстоит выяснить, играют ли события фосфорилирования роль в восприятии репликационных стрессов. Недавние исследования подчеркивают активацию киназы перекрестным фосфорилированием в B. subtilis и M.tuberculosis , что свидетельствует о существовании бактериальных сигнальных каскадов, сравнимых с таковыми у эукариот (Baer et al., 2014; Shi et al., 2014a). Хотя набор белков, на которые нацелены эти потенциальные регуляторные каскады, еще не известен, все большее количество крупномасштабных протеомных исследований на основе масс-спектрометрии обнаруживает, что белки, участвующие в различных связанных с ДНК процессах, также фосфорилируются в бактериях (Macek et al., 2007, 2008; Voisin et al., 2007; Soufi et al., 2008; Ravichandran et al., 2009; Prisic et al., 2010; Schmidl et al., 2010; Ge et al., 2011; Manteca et al., 2011; Misra et al., 2011; Бай и Джи, 2012; Эльсхольц и др., 2012; Esser et al., 2012; Hansen et al., 2013; Соарес и др., 2013; Ян и др., 2013; Кеннелли, 2014; Ортега и др., 2014; Равикумар и др., 2014; Nakedi et al., 2015; Пан и др., 2015; Таблица 1). Другой подход, основанный на дрожжевом двугибридном обнаружении белков-партнеров по связыванию белков , протеинкиназы и фосфатазы B. subtilis , идентифицирует многочисленные потенциальные ДНК-связывающие белковые субстраты, некоторые из которых уже охарактеризованы как фосфопротеины в других исследованиях или дополнительно подтверждены vivo и / или in vitro (Shi et al., 2014b; Таблица 2, Рисунок 1). Это исследование закладывает основу для изучения роли фосфорилирования в модуляции связанных с ДНК процессов у этих бактерий.
Таблица 1. Фосфорилирование белков, участвующих в ДНК-зависимых механизмах и процессах у бактерий .
Таблица 2. ДНК-связывающие белки, нацеленные на фосфорилирование в B. subtilis .
Рис. 1. Сеть PPI с центром на ser / thr (желтые узлы, синие края) и tyr (красные узлы, черные края) киназ, фосфатаз и модуляторов B.subtilis обнаруживает потенциальную регуляцию фосфорилирования различных ДНК-связанных путей . Белки представлены в виде узлов, соединенных ребрами. Потенциальные субстраты, определенные как связанные как киназой, так и родственной фосфатазой, представлены ромбами. HTH-содержащие белки, связанные более чем одной киназой, представлены квадратами; Фосфо-белки, охарактеризованные in vitro , помечены красным цветом. Белки, фосфорилированные у других бактерий, отмечены звездочкой.Другие взаимодействия между белками показаны светло-серыми краями (из Marchadier et al., 2011; Shi et al., 2014b). Подтвержденное in vitro фосфорилирование киназа-субстрат показано пунктирными линиями.
Примером фосфорилированного многофункционального белка, играющего роль в различных процессах ДНК, является одноцепочечный ДНК-связывающий белок SSB (Mijakovic et al., 2006; Vujaklija and Macek, 2012). У бактерий белки SSB собираются на ДНК в виде гомодимеров или тетрамеров, каждая единица состоит из N-концевого ДНК-связывающего домена и C-концевого внутренне неупорядоченного хвоста, который опосредует взаимодействие с многочисленными белками (Kozlov et al., 2015). Бактериальные белки SSB в основном связаны с механизмом репликации в реплицирующих вилках и служат центральными узлами для координации репликации и репарации ДНК (Lecointe et al., 2007; Costes et al., 2010; Antony et al., 2013; Bentchikou et al., др., 2015). Как и у бактерий, эукариотический однонитевой связывающий белок RPA выполняет множество функций в защите оцДНК, распознавании и стимулировании восстановления повреждений ДНК с помощью ИПП (Oakley and Patrick, 2010; Maréchal and Zou, 2015). В частности, фосфорилирование RPA негативно регулирует его связывание с ДНК, а также его взаимодействие с белками-партнерами (Binz et al., 2003; Oakley et al., 2003). B. subtilis обладает двумя однонитевыми связывающими белками SSBA и B, соответственно фосфорилированными по тирозину, идентифицированному как Tyr82 в SSBA (Mijakovic et al., 2006). Кроме того, фосфо-сайт на Thr52 также был идентифицирован в SSBB (Table 1; Jers et al., 2010; Elsholz et al., 2012). Исследование 3D-структуры комплекса SSB / ДНК показывает, что Tyr82 (а также соседний остаток Thr52 Trp54) участвуют в стэкинге с ДНК (Yadav et al., 2012).Это убедительно подтверждает наблюдение, что фосфорилирование SSBA по остатку Tyr82 отрицательно модулирует его связывание с ДНК in vitro и регулирует клеточный ответ на повреждение ДНК (Mijakovic et al., 2006). Следовательно, роль фосфорилирования белка SSB в модулировании ответа на повреждение клеточной ДНК может быть эволюционно консервативной у эукариот и прокариот.
Еще один убедительный аргумент в пользу взаимодействия репликативной ДНК-геликазы DnaC с Ser / Thr-киназой PrkD подтвержден тестами in vitro и высокой корреляцией коэкспрессий (Shi et al., 2014б). Фосфорилирование многочисленных компонентов механизма репликации ДНК, а также белков, участвующих в различных этапах цикла репликации, было идентифицировано у одной или нескольких бактерий среди Escherichia, Pseudomonas, Helicobacter, Camplylobacter, Listeria, Bacillus, Mycoplasma, Clostridium. , Роды Deinoccocus, Synechoccus и Streptococcus (таблицы 1, 2). Ортологи высококонсервативной ДНК-полимеразы PolA, ДНК-геликазы DnaC и одноцепочечного связывающего белка SSB были обнаружены фосфорилированными, что потенциально отражает существование общих регуляторных механизмов для контроля их активности у разных видов.
Сохранение фосфорилирования внутри семейств белковых доменов указывает на белки с высоким регуляторным потенциалом (Maathuis, 2008). Примечательно, что несколько фосфопротеомных анализов сообщили о фосфорилировании двух крупнейших субъединиц β и β ‘аппарата РНК-полимеразы по серину, треонину или тирозину у семи видов бактерий (Таблица 1). У эукариот привлечение факторов к удлиняющемуся RNAPII регулируется дифференциальным и динамическим фосфорилированием остатков серина, треонина и тирозина в С-концевом домене большой субъединицы Rpb1 во время цикла транскрипции (Heidemann et al., 2013). Хотя наличие фосфорилирования основных компонентов РНК-полимеразы как в бактериях, так и в эукариотических клетках не предполагает схожих регуляторных механизмов, это предполагает, что эволюционные ограничения на регуляцию экспрессии генов привели к нацеливанию на механизм транскрипции для модулирования его активности и способности к взаимодействуют с другими факторами.
Биологическая роль фосфопротеинов в координации ДНК-метаболизма с переходным состоянием и развитием клетки в
B.subtilisБольшая группа белков, участвующих в различных путях репликации и репарации ДНК, идентифицирована с фосфо-сайтами, предполагая, что фосфорилирование может играть роль в координации различных клеточных ответов на повреждение ДНК и целостности реплицирующейся хромосомы (Таблица 1). Регулирование путем фосфорилирования процессов, связанных с ДНК, было зарегистрировано в B. subtilis . Один процесс включает ДНК-рекомбиназу RecA, многофункциональный белок, играющий важную роль в гомологичной рекомбинации и репарации двухцепочечных разрывов ДНК, а также в инициации клеточного SOS-ответа на повреждение ДНК у бактерий (Кузьминов, 2001; Chen et al., 2008; Бутала и др., 2009). Недавно было описано, что RecA играет роль в мониторинге и поддержании целостности хромосом в начале развития спор (Bidnenko et al., 2013). Эта новая активность регулируется фосфорилированием оцДНК-зависимой Ser / Thr-киназы YabT, экспрессируемой во время споруляции. Хотя молекулярный механизм, лежащий в основе этой активности, еще не изучен, фосфорилирование RecA на N-конце S2 играет роль во временном сдерживании дальнейшего развития споруляции при обнаружении повреждений ДНК.Из недавних открытий, что RecA также подвергается фосфорилированию тирозина с помощью PtkA, мы можем ожидать более сложную картину для регуляции его активности у B. subtilis (Shi et al., 2014b).
ДНК-связывающий онтогенетический белок RacA иллюстрирует предполагаемую роль фосфорилирования в координации сегрегации хромосом с асимметричным делением, имеющим место во время споруляции у B. subtilis . Во время споруляции RacA закрепляет расщепляющуюся хромосому на клеточном полюсе передспоры DivIVA-зависимым образом (Ben-Yehuda et al., 2003; Ву и Эррингтон, 2003; Бен-Иегуда и др., 2005; Перри и Эдвардс, 2006 г.). В сети PPI B. subtilis RacA связан как с Ser / Thr киназой YabT, так и с родственной фосфатазой SpoIIE, предполагая, что он может быть субстратом обоих (Shi et al., 2014b). Это предположение, дополнительно подтвержденное in vitro , также подтверждено существованием высокой положительной корреляции экспрессии генов racA и spoIIE в различных физиологических условиях, что указывает на то, что они являются частью одних и тех же биологических процессов.
Nucleoid-associated protein (NAPs) представляют собой гистоноподобные белки, участвующие в модификации структурной организации хромосом путем изменения их топологии на глобальном или локальном уровне (Dillon and Dorman, 2010). Как следствие своих ДНК-связывающих свойств, белки NAP, как обнаружено, модулируют различные ДНК-процессы и действуют как глобальные регуляторы экспрессии генов (Dorman, 2013). Белки NAP разнообразны и присутствуют во всех живых клетках (Dillon, Dorman, 2010; Dorman, 2013). Изучение данных фосфопротеомики в базе данных сайтов фосфорилирования у прокариот dbPSP показывает, что многие представители этого класса белков фосфорилируются, включая HupA, HupB, H-NS (и H-NS, такие как StpA), Dps и хромосомы структурной поддержки (SMC). ) белки (таблица 1).Особенностью этого класса белков является наличие фосфо-сайтов в широком спектре бактериальных ортологов (Таблица 1), предполагая, что они могут функционально регулироваться фосфорилированием. Недавнее открытие, что фосфорилирование гистоноподобного белка HupB с помощью киназ STKPs отрицательно модулирует его способность связывать ДНК в M. tuberculosis , подтверждает это предположение (Gupta et al., 2014). Состояние фосфорилирования белка HupB коррелирует с экспрессией киназ pknE и pknF .Их экспрессия высока во время экспоненциальной фазы роста и низка при достижении стационарной фазы. Это дифференциальное фосфорилирование строго указывает на потенциальный способ регуляции HupB , который способствует взаимодействию с ДНК во время стационарной фазы, способствуя уплотнению хромосомы.
MinD, белок, подобный сигнальному каркасу
Киназы регулируются путем образования специфических ассоциаций с массивами различных белков, включая ингибиторы и активаторы киназ, а также с каркасными и якорными белками, которые нацелены на киназные комплексы в определенные субклеточные участки.Белки каркаса представляют собой универсальные центры, которые пространственно и временно связывают сигнальные компоненты в эукариотических клетках. Исследования дрожжей на основе интерактомов дают определение классических сигнальных каркасных белков как (i) играющих активную роль в передаче сигналов, но при этом лишенных каталитической активности, необходимой для передачи сигналов, и (ii) способности способствовать взаимодействию нескольких компонентов передачи сигналов каскады в определенном месте клетки, чтобы регулировать их активность (Zeke et al., 2009).Парадигма эукариотического каркасного белка — это белок Ste5 пути митоген-активируемой протеинкиназы (MAPK) в дрожжах, который изолирует три протеинкиназы MAPKKK Ste11, MAPKK Ste7 и MAPK Fus3, чтобы способствовать сигнальному каскаду (Good et al., 2009) .
Недавнее сообщение о дрожжевой двугибридной сети PPI, сосредоточенной на тирозинкиназе в B. subtilis , предоставляет 2D-карту потенциальных партнеров, взаимодействующих с BY-киназой (Shi et al., 2014b). С многочисленными белками-партнерами связываются родственные пары киназа / фосфатаза, что подтверждает гипотезу о том, что они являются субстратами.Однако из этого правила есть исключения. Регулятор деления бактериальных клеток MinD контактирует как с тирозинкиназой PtkA, так и с тирозинфосфатазой PtpZ в сети PPI, но не нацелен на фосфорилирование с помощью PtkA (Shi et al., 2014b). Поразительно, что PtkA фосфорилирует белок отбора участков перегородки DivIVA, который рекрутирует MinD на полюсах клетки через MinJ. Исследования субклеточной локализации показывают, что PtkA локализуется на полюсе клетки MinD-зависимым образом. Фенотипы дефекта перегородки наблюдаются в отсутствие PtkA и усиливаются на фоне дефицита zapA , что убедительно указывает на то, что PtkA может играть роль во время деления клеток.Все эти наблюдения подтверждают гипотезу о том, что B. subtilis MinD, в дополнение к его характерной роли в рекрутировании FtsZ-негативного регулятора MinC для предотвращения образования Z-кольца на полюсах клетки (Gregory et al., 2008), также действует как внутриклеточный организатор сигнальных компонентов, участвующих в регуляции цитокинеза (Shi et al., 2014b).
MinD принадлежит к классу ParA-подобных AAA + ATPases и имеет структурную гомологию с PtkA (Derouiche et al., 2015b).Однако в нем отсутствует детерминант кластера тирозина для аутофосфорилирования, и поэтому он не является каталитически активной киназой. Важно отметить, что, подобно TkmA, трансмембранному и родственному модулятору PtkA, необходимому для общей активации киназы в клетке, MinD связывается и активирует PtkA. В сети PPI MinD также взаимодействует со второй B. subtilis BY-киназой PktB, Ser / Thr-киназой Хэнкса YabT и фосфатазой (PtpZ), что указывает на потенциальную способность доставлять различные компоненты тирозина, но также в непосредственной близости находятся пути фосфорилирования серина / треонина (рис. 2).Во многих отношениях MinD выполняет определение каркаса сигнального белка, который позволяет нескольким акторам, принадлежащим к разным путям, совместно локализоваться на полюсах клетки. Примечательно, что в фосфотирозиновой сети B. subtilis PPI MinD демонстрирует взаимодействующий ландшафт, аналогичный таковому у TkmA (Shi et al., 2014b; Figure 2). Как трансмембранный белок, TkmA классифицируется как рецепторный белок, активирующий PtkA при обнаружении внешних входов, в то время как MinD полностью соответствует определению классического каркаса, обеспечивая близость киназы / фосфатазы и субстрата в определенное время и в определенном месте во время бактерий. клеточный цикл.Однако потенциальная способность TkmA связываться с более чем одной киназой, фосфатазой и различными субстратами PtkA предполагает, что этот рецептор также может действовать как стыковочная платформа для активации событий передачи сигналов тирозинкиназы (Jers et al., 2010).
Рис. 2. Сходство профиля PPI между модуляторами белка TkmA (якорь) и MinD (каркас) в B. subtilis . Пути фосфорилирования Tyr и Ser / Thr отмечены красным и желтым цветом соответственно.Путь деления клеток обозначен зеленым.
MinD, действующий как каркас, следовательно, предположительно способствует PtkA-опосредованному фосфорилированию DivIVA в B. subtilis (Shi et al., 2014b). Описано, что фосфорилирование DivIVA и других гомологов киназами Ser / Thr играет роль в регулировании апикального роста и полярности клеток у Actinobateria, а также в управлении синтезом пептидогликана во время удлинения клеток у стрептококков (Fleurie et al., 2012; Hempel et al. al., 2012; Fleurie et al., 2014; Помпео и др., 2015). Настоящий вопрос о роли фосфорилирования DivIVA по тирозину в регуляции его динамики от полюсов клетки до будущей перегородки теперь решается в B. subtilis . У этой бактерии PtkA может модулировать DivIVA на полюсе клетки посредством посадки / активации MinD. Потенциальное присутствие др. Сигнальных компонентов, таких как фосфатаза PtpZ, также может способствовать точной настройке таких регуляторов. Взаимодействие киназы YabT Ser / Thr споруляции с MinD также может дать ключ к пониманию того, как DivVIA переключается с MinCD (J) -опосредованного контроля сборки FtsZ во время вегетативного роста на опосредованное RacA закрепление хромосомы на переднем полюсе. компартмент спор в начале споруляции (Ben-Yehuda et al., 2003; Ву и Эррингтон, 2003; Бен-Иегуда и др., 2005; Перри и Эдвардс, 2006; Брамкамп и др., 2008). Таким образом, ожидается, что эта новая функция MinD в качестве сигнального каркаса будет участвовать в координации цитокинеза, терминальной стадии клеточного цикла, с другими путями во время различных стилей жизни Bacillus .
MinD / ParA-подобные белки широко распространены среди бактерий. Они не только участвуют в различных аспектах регуляции клеточного деления и сегрегации хромосом, но также в полярной локализации клеточных механизмов, таких как те, которые управляют конъюгативным переносом или хемотаксисом, а также те, которые организуют полярное позиционирование пилей IV типа (Киркпатрик и Viollier, 2012; Lutkenhaus, 2012; Treuner-Lange, Søgaard-Andersen, 2014).ParA / MinD-подобные белки часто описываются как белковые концентраторы, ответственные за архитектурную и пространственную организацию необходимых компонентов, управляющих этими процессами (Lutkenhaus, 2012). В асимметрично делящейся бактерии C. crescentus механизмы, лежащие в основе разделения детерминант клеточной судьбы на два структурно различных полюса клетки, также требуют, чтобы MinD / ParA-подобные белки достигли полярной локализации хромосом и деления клетки (Thanbichler and Шапиро, 2006).MinD-подобная АТФаза MipZ образует динамический комплекс с разделяющим ДНК белком ParB в хромосомном ориджине репликации, а также отрицательно регулирует полимеризацию FtsZ (Du and Lutkenhaus, 2012; Kiekebusch et al., 2012). Посредством гидролиза АТФ, MipZ действует как молекулярный переключатель, чтобы соединить сегрегацию хромосом с контролем позиционирования кольца FtsZ в середине клетки в C. crescentus (Thanbichler and Shapiro, 2006). Хотя его роль в сигнальном каркасе не доказана, недавние исследования подчеркивают важность фосфорилирования ParB в локализации и функции белков, участвующих в сегрегации хромосом у микобактерий (Baronian et al., 2015). Наконец, открытие, что ParA-подобная BY-киназа CspD, кодируемая капсульным опероном cps в S. pneumoniae , который играет роль в координации капсульного полисахарида с сегрегацией хромосом посредством взаимодействия с ParB, приводит к гипотезе, что эта киназа может действовать как молекулярный каркас (Nourikyan et al., 2015). Хотя до сих пор не было обнаружено, что белки фосфорилируются с помощью CpsD, гидролиз АТФ, ведущий к аутофосфорилированию CpsD, играет важную роль в регулировании динамики локализации белков ParB, связанных с источником хромосомной репликации, и обеспечивает молекулярный переключатель для соединения клетки цикл с удлинением клеток (Nourikyan et al., 2015).
Выводы
Крупномасштабное профилирование фосфопротеинов и фосфо-сайтов с помощью протеомики на основе масс-спектрометрии, дифференциальной фосфопротеомики в физиологических условиях и фосфопротеомов, связанных с киназой, помогает идентифицировать киназ-специфические субстраты и понимать функциональную динамику сетей фосфорилирования. Кроме того, интерактомика выявляет взаимодействия киназа-белок, выявляя не только потенциальные субстраты, но также якоря и модуляторы.Следовательно, фосфопротеомика и интерактомика являются мощными и взаимодополняющими подходами, позволяющими разработать схему сигнальных сетей, ориентированных на киназу и фосфатазу. Постоянно растущие данные крупномасштабных исследований фосфопротеома у бактерий в сочетании с идентификацией киназы, фосфатазы, субстратов и модуляторов обеспечивают важную информацию о клеточных регуляторах. Это также дает уникальную возможность понять, как фосфорилирование участвует в регуляции активности белков, их взаимодействий с другими белками и их локализации в бактериальной клетке.
У многих бактерий фосфорилирование белков, участвующих в различных связанных с ДНК процессах, вместе с биологическими доказательствами их роли во время клеточного цикла, предполагает существование регуляторов контрольных точек, подобных эукариотам. Во всех живых организмах события клеточного цикла включают временную и пространственную координацию репликации и сегрегации хромосом с цитокинезом, причем весь процесс также координируется с ростом клеток. У эукариот существование очень сложных сигнальных сетей обеспечивается контролем качества и белками контрольных точек, которые координируют эти последовательные события и запускают остановку клеточного цикла, когда что-то идет не так.У бактерий различные процессы более взаимосвязаны. Следовательно, точное выполнение каждого шага относительно других во времени и пространстве имеет решающее значение и требует строгих регулирующих механизмов. Обнаружение в B. subtilis того, что клеточное деление MinD может действовать как сигнальный концентратор для усиления близости различных компонентов пути фосфорилирования Tyr и Ser / Thr, наряду с белком сайта перегородки DivIA, снова намекает на существование опосредованной каркасом передачи сигнала у бактерий.Кроме того, недавнее открытие, что бактериальные киназы сами могут настраивать свою активность посредством фосфорилирования, усложняет картину (Shi et al., 2014a). Однако это также предполагает, что, как и у эукариот, такие бактериальные каркасы могут предлагать универсальные стратегии для динамической координации клеточных процессов посредством передачи сигналов.
Авторские взносы
TG, SP, LS и AD проанализировали библиографические данные. TG и SP предоставили таблицы. М.Н. написал рукопись.И.М. пересмотрел его критически. Все авторы дали окончательное одобрение версии.
Финансирование
Эта работа была поддержана грантами от Agence Nationale de la Recherche (2010-BLAN-1303-01) для MN и IM и Vetenskapsrådet (2015-05319) и Фонда Novo Nordisk для IM. TG поддерживается Европейским Союзом, Мария Кюри ITN AMBER, 317338.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить Кристофа Гранжассе за ценные комментарии к рукописи.
Список литературы
Энтони, Э., Вейланд, Э., Юань, К., Манхарт, К. М., Нгуен, Б., Козлов, А. Г. и др. (2013). Множественные С-концевые хвосты в пределах одного гомотетрамера E. coli SSB координируют репликацию и репарацию ДНК. J. Mol. Биол. 425, 4802–4819. DOI: 10.1016 / j.jmb.2013.08.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баер, К.Э., Иавароне А. Т., Альбер Т. и Сассетти К. М. (2014). Биохимическое и пространственное совпадение во временной сети взаимодействия протеинкиназ Ser / Thr Mycobacterium tuberculosis . J. Biol. Chem. 289, 20422–20433. DOI: 10.1074 / jbc.M114.559054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бай, X., и Ji, Z. (2012). Фосфопротеомное исследование бактерии-продуцента растворителя Clostridium acetobutylicum . Заявл.Microbiol. Biotechnol. 95, 201–211. DOI: 10.1007 / s00253-012-4156-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барониан, Г., Гинда, К., Берри, Л., Коэн-Гонсауд, М., Закшевска-Червинска, Дж., Якимович, Д. и др. (2015). Фосфорилирование Mycobacterium tuberculosis ParB участвует в регуляции системы сегрегации хромосом ParABS. PLoS ONE 10: e0119907. DOI: 10.1371 / journal.pone.0119907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бентчиков, Э., Chagneau, C., Long, E., Matelot, M., Allemand, J. F., and Michel, B. (2015). Связаны ли SSB-взаимодействующие белки RecO, RecG, PriA и DnaB-взаимодействующий белок rep с прогрессирующими репликационными вилками в Escherichia coli ? PLoS ONE 10: e0134892. DOI: 10.1371 / journal.pone.0134892
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бен-Иегуда, С., Фуджита, М., Лю, X.С., Горбатюк, Б., Скоко, Д., Ян, Дж., И др. (2005). Определение центромеры-подобного элемента в Bacillus subtilis путем идентификации сайтов связывания для закрепляющегося на хромосоме белка RacA. Мол. Cell 17, 773–782. DOI: 10.1016 / j.molcel.2005.02.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бидненко В., Ши Л., Кобир А., Вентру М., Пижонно Н., Генри К. и др. (2013). Bacillus subtilis серин / треониновая протеинкиназа YabT участвует в развитии спор посредством фосфорилирования бактериальной рекомбиназы. Мол. Microbiol. 88, 921–935. DOI: 10.1111 / mmi.12233
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бинц, С.К., Лао, Ю., Лоури, Д. Ф., и Уолд, М. С. (2003). Домен фосфорилирования 32-кДа субъединицы репликационного протеина А (RPA) модулирует взаимодействия RPA-ДНК. Доказательства межсубъединичного взаимодействия. J. Biol. Chem. 278, 35584–35591. DOI: 10.1074 / jbc.M305388200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бунстра, М., де Йонг, И. Г., Шолефилд, Г., Мюррей, Х., Койперс, О. П., и Вининг, Дж. У. (2013). Spo0A регулирует количество копий хромосомы во время споруляции путем прямого связывания с источником репликации в Bacillus subtilis . Мол. Microbiol. 87, 925–938. DOI: 10.1111 / mmi.12141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брамкамп, М., Эмминс, Р., Уэстон, Л., Донован, К., Дэниел, Р. А., и Эррингтон, Дж. (2008). Новый компонент системы отбора сайтов деления Bacillus subtilis и новый способ действия ингибитора деления MinCD. Мол. Microbiol. 70, 1556–1569. DOI: 10.1111 / j.1365-2958.2008.06501.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бернсайд, К., Лембо, А., Харрелл, М. И., Герни, М., Сюэ, Л., Бин Тран, Н. Т. и др. (2011). Серин / треонинфосфатаза Stp1 опосредует посттранскрипционную регуляцию гемолизина, автолиз и вирулентность Streptococcus группы B . J. Biol. Chem. 286, 44197–44210. DOI: 10.1074 / jbc.M111.313486
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастилья-Льоренте, В., Муньос-Эспин, Д., Вильяр, Л., Салас, М., и Мейер, В. Дж. (2006). Spo0A, ключевой регулятор транскрипции для входа в споруляцию, является ингибитором репликации ДНК. EMBO J. 25, 3890–3899. DOI: 10.1038 / sj.emboj.7601266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Костес А., Леконт Ф., Макговерн С., Кевийон-Шеруэль С. и Полард П. (2010). С-концевой домен бактериального белка SSB действует как центр поддержки ДНК в активных ответвлениях репликации хромосом. PLoS Genet. 6: e1001238. DOI: 10.1371 / journal.pgen.1001238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деруиш, А., Ши, Л., Бидненко, В., Вентру, М., Пигонно, Н., Франц-Вахтель, М. и др. (2015a). SalA Bacillus subtilis представляет собой зависимый от фосфорилирования регулятор транскрипции, который репрессирует scoC и активирует продукцию экзопротеазы AprE. Mol Microbiol. 97, 1195–1208. DOI: 10.1111 / mmi.13098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деруиш А., Ши Л., Калантари А. и Миякович И. (2015b). Эволюция и возня: что общего между протеинкиназой, регулятором транскрипции и белками сегрегации хромосом / делением клеток? Curr.Genet . 62, 67–70. DOI: 10.1007 / s00294-015-0513-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Септенвиль, А. Л., Дуигу, С., Бубакри, Х., Мишель, Б. (2012). Реверс репликационной вилки после столкновения репликации и транскрипции. PLoS Genet. 8: e1002622. DOI: 10.1371 / journal.pgen.1002622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дидье, Дж. П., Коззоне, А. Дж., И Дюкло, Б. (2010). Фосфорилирование регулятора вирулентности SarA модулирует его способность связывать ДНК в Staphylococcus aureus . FEMS Microbiol. Lett. 306, 30–36. DOI: 10.1111 / j.1574-6968.2010.01930.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дорман, К. Дж. (2013). Архитектура генома и глобальная регуляция генов у бактерий: продвижение к единой модели? Nat. Rev. Microbiol. 11, 349–355. DOI: 10.1038 / nrmicro3007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дунгравала, Х., Роуз, К. Л., Бхат, К. П., Мохни, К.N., Glick, G.G., Couch, F. B., et al. (2015). Контрольная точка репликации предотвращает два типа обрушения вилки, не регулируя стабильность реплисома. Мол. Ячейка 59, 998–1010. DOI: 10.1016 / j.molcel.2015.07.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эльсхольц, А.К., Тургай, К., Михалик, С., Хесслинг, Б., Гронау, К., Эртель, Д. и др. (2012). Глобальное влияние фосфорилирования протеина аргинина на физиологию Bacillus subtilis . Proc. Natl. Акад. Sci. США 109, 7451–7456. DOI: 10.1073 / pnas.1117483109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эссер Д., Фам Т. К., Рейманн Дж., Альберс С. В., Зиберс Б. и Райт П. К. (2012). Изменение источника углерода вызывает драматические эффекты в фосфопротеоме археи Sulfolobus solfataricus. J. Proteome Res. 11, 4823–4833. DOI: 10.1021 / pr300190k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Флери, А., Cluzel, C., Guiral, S., Freton, C., Galisson, F., Zanella-Cleon, I., et al. (2012). Мутационное рассечение S / T-киназы StkP выявляет критическую роль в делении клеток Streptococcus pneumoniae . Мол. Microbiol. 83, 746–758. DOI: 10.1111 / j.1365-2958.2011.07962.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fleurie, A., Manuse, S., Zhao, C., Campo, N., Cluzel, C., Lavergne, J.P., et al. (2014). Взаимодействие серин / треонинкиназы StkP и паралогов DivIVA и GpsB в удлинении и делении пневмококковых клеток. PLoS Genet. 10: e1004275. DOI: 10.1371 / journal.pgen.1004275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гэ Р., Сунь X., Сяо К., Инь X., Шань В., Чен З. и др. (2011). Фосфопротеомный анализ патогенной бактерии Helicobacter pylori выявляет чрезмерную представленность фосфорилирования тирозина и многократного фосфорилирования белков. Proteomics 11, 1449–1461. DOI: 10.1002 / pmic.201000649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хорошее, м., Танг, Г., Синглтон, Дж., Ременьи, А., и Лим, В. А. (2009). Каркас Ste5 управляет передачей сигналов спаривания, каталитически разблокируя киназу Fus3 MAP для активации. Ячейка 136, 1085–1097. DOI: 10.1016 / j.cell.2009.01.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грегори, Дж. А., Беккер, Э. К., и Польяно, К. (2008). Bacillus subtilis MinC дестабилизирует FtsZ-кольца на новых полюсах клетки и способствует определению времени деления клеток. Genes Dev. 22, 3475–3488. DOI: 10.1101 / gad.1732408
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гупта, М., Саджид, А., Шарма, К., Гош, С., Арора, Г., Сингх, Р. и др. (2014). HupB, нуклеоид-ассоциированный белок Mycobacterium tuberculosis , модифицирован сериновыми / треониновыми протеинкиназами in vivo . J. Bacteriol. 196, 2646–2657. DOI: 10.1128 / JB.01625-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хансен, А.M., Chaerkady, R., Sharma, J., Díaz-Mejía, J. J., Tyagi, N., Renuse, S., et al. (2013). Протеом фосфотирозина Escherichia coli относится к основным путям и вирулентности. PLoS Pathog. 9: e1003403. DOI: 10.1371 / journal.ppat.1003403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хайдеманн, М., Хинтермайр, К., Фосс, К., и Эйк, Д. (2013). Паттерны динамического фосфорилирования CTD РНК-полимеразы II во время транскрипции. Biochim.Биофиз. Acta 1829, 55–62. DOI: 10.1016 / j.bbagrm.2012.08.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хемпель, А. М., Кантли, С., Молле, В., Ван, С. Б., Налдрет, М. Дж., Паркер, Дж. Л. и др. (2012). Протеинкиназа Ser / Thr AfsK регулирует полярный рост и ветвление гиф у нитчатых бактерий Streptomyces. Proc. Natl. Акад. Sci. США 109, E2371 – E2379. DOI: 10.1073 / pnas.1207409109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джерс, К., Pedersen, M. M., Paspaliari, D. K., Schütz, W., Johnsson, C., Soufi, B., et al. (2010). Bacillus subtilis BY-киназа PtkA контролирует ферментативную активность и локализацию его белковых субстратов. Мол. Microbiol. 77, 287–299. DOI: 10.1111 / j.1365-2958.2010.07227.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калантари А., Деруиш А., Ши Л. и Миякович И. (2015). Фосфорилирование серина / треонина / тирозина регулирует связывание ДНК бактериальных регуляторов транскрипции. Микробиология 161, 1720–1729. DOI: 10.1099 / mic.0.000148
CrossRef Полный текст | Google Scholar
Канехиса М., Гото С., Сато Ю., Фурумичи М. и Танабэ М. (2012). KEGG для интеграции и интерпретации крупномасштабных наборов молекулярных данных. Nucleic Acids Res. 40, D109 – D114. DOI: 10.1093 / nar / gkr988
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кикебуш Д., Мичи, К. А., Эссен, Л. О., Лёве, Дж., И Танбихлер, М.(2012). Локализованная димеризация и формирование градиента управления связыванием нуклеоидов ингибитором деления бактериальных клеток MipZ. Мол. Cell 46, 245–259. DOI: 10.1016 / j.molcel.2012.03.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кобир А., Понсе С., Бидненко В., Делюмо О., Джерс К., Зухир С. и др. (2014). Фосфорилирование регулятора гена Bacillus subtilis AbrB модулирует его ДНК-связывающие свойства. Мол. Microbiol. 92, 1129–1141.DOI: 10.1111 / MMI.12617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Козлов, А.Г., Вейланд, Э., Миттал, А., Вальдман, В., Энтони, Э., Фацио, Н. и др. (2015). Внутренне неупорядоченные С-концевые хвосты одноцепочечного ДНК-связывающего белка E. coli регулируют кооперативное связывание с одноцепочечной ДНК. J. Mol. Биол. 427, 763–774. DOI: 10.1016 / j.jmb.2014.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кузьминов, А.(2001). Репликация ДНК встречается с генетическим обменом: хромосомное повреждение и его восстановление путем гомологичной рекомбинации. Proc. Natl. Акад. Sci. США 98, 8461–8468. DOI: 10.1073 / pnas.151260698
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лэнгстон, Л. Д., Индиани, К., и О’Доннелл, М. (2009). Куда идет реплисома: новые взгляды на динамическую природу механизма репликации ДНК. Cell Cycle 8, 2686–2691. DOI: 10.4161 / cc.8.17.9390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лекойнт, Ф., Sérèna, C., Velten, M., Costes, A., McGovern, S., Meile, J.C., et al. (2007). Ожидаемый арест хромосомной вилки репликации: SSB нацеливается на репарацию геликазы ДНК в активные вилки. EMBO J. 26, 4239–4251. DOI: 10.1038 / sj.emboj.7601848
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х. Дж., Лан, Л., Пэн, Г., Чанг, В. К., Хсу, М. К., Ван, Ю. Н. и др. (2015). Фосфорилирование тирозина 370 ATM положительно регулирует ответ на повреждение ДНК. Cell Res. 25, 225–236. DOI: 10.1038 / cr.2015.8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линь В., Ван Дж., Ин В. и Цянь X. (2012). Оптимизация обогащения диоксидом титана фосфопептидами и применение в анализе фосфопротеома Thermoanaerobacter tengcongensis. Se Pu 30, 763–769. DOI: 10.3724 / SP.J.1123.2012.04027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацек, Б., Гнад, Ф., Суфи, Б., Кумар, К., Олсен, Дж. В., Миякович, И. и др. (2008). Фосфопротеомный анализ E. coli показывает эволюционную консервацию бактериального фосфорилирования Ser / Thr / Tyr. Мол. Клетка. Протеомика 7, 299–307. DOI: 10.1074 / mcp.M700311-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацек, Б., Миякович, И., Олсен, Дж. В., Гнад, Ф., Кумар, К., Йенсен, П. Р. и др. (2007). Фосфопротеом серин / треонин / тирозин модельной бактерии Bacillus subtilis . Мол. Клетка. Протеомика 6, 697–707. DOI: 10.1074 / mcp.M600464-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Manteca, A., Ye, J., Sánchez, J., and Jensen, O. N. (2011). Фосфопротеомный анализ развития Streptomyces показывает обширное фосфорилирование белков, сопровождающее бактериальную дифференцировку. J. Proteome Res. 10, 5481–5492. DOI: 10.1021 / pr200762y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Манусе, С., Флери, А., Цуккини, Л., Лестерлин, К., и Гранжасс, К. (2015). Роль эукариотоподобных серин / треониновых киназ в делении и морфогенезе бактериальных клеток. FEMS Microbiol. Ред. . 40, 41–56. DOI: 10.1093 / femsre / fuv041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marchadier, E., Carballido-López, R., Brinster, S., Fabret, C., Mervelet, P., Bessieres, P., et al. (2011). Расширенная сеть белок-белковых взаимодействий в Bacillus subtilis обнаруживает группу узловых точек: исследование с помощью интегративного подхода. Proteomics 11, 2981–2991. DOI: 10.1002 / pmic.201000791
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Maréchal, A., и Zou, L. (2015). Одноцепочечная ДНК, покрытая RPA, как платформа для посттрансляционных модификаций реакции на повреждение ДНК. Cell Res. 25, 9–23. DOI: 10.1038 / cr.2014.147
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миякович, И., Петранович, Д., Мацек, Б., Чепо, Т., Манн, М., Davies, J., et al. (2006). Бактериальные одноцепочечные ДНК-связывающие белки фосфорилируются по тирозину. Nucleic Acids Res. 34, 1588–1596. DOI: 10.1093 / nar / gkj514
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мисра, С. К., Милоханич, Э., Аке, Ф., Миякович, И., Дойчер, Дж., Монне, В. и др. (2011). Анализ серин / треонин / тирозин фосфопротеома патогенной бактерии Listeria monocytogenes выявляет фосфорилированные белки, связанные с вирулентностью. Протеомика 11, 4155–4165. DOI: 10.1002 / pmic.201100259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накеди, К. К., Нел, А. Дж., Гарнет, С., Блэкберн, Дж. М., и Соарес, Н. К. (2015). Сравнительная фосфопротеомика Ser / Thr / Tyr между двумя видами микобактерий: быстрорастущей Mycobacterium smegmatis и медленно растущей Mycobacterium bovis BCG. Фронт. Microbiol. 6: 237. DOI: 10.3389 / fmicb.2015.00237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нурикян, Дж., Kjos, M., Mercy, C., Cluzel, C., Morlot, C., Noirot-Gros, M. F., et al. (2015). Аутофосфорилирование бактериальной тирозинкиназы CpsD связывает синтез капсулы с клеточным циклом в Streptococcus pneumoniae . PLoS Genet. 11: e1005518. DOI: 10.1371 / journal.pgen.1005518
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Окли Дж. Дж., Патрик С. М., Яо Дж., Карти М. П., Турчи Дж. Дж. И Диксон К. (2003). Фосфорилирование RPA в митозе изменяет связывание ДНК и белок-белковые взаимодействия. Биохимия 42, 3255–3264. DOI: 10.1021 / bi026377u
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ортега К., Ляо Р., Андерсон Л. Н., Рустад Т., Оллодарт А. Р., Райт А. Т. и др. (2014). Mycobacterium tuberculosis Ser / Thr протеинкиназа B опосредует кислород-зависимый переключатель репликации. PLoS Biol. 12: e1001746. DOI: 10.1371 / journal.pbio.1001746
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пан, З., Ван, Б., Чжан, Ю., Ван, Ю., Уллах, С., Цзян, Р. и др. (2015). dbPSP: тщательно подобранная база данных по сайтам фосфорилирования белков у прокариот. База данных 2015: bav031. DOI: 10.1093 / база данных / bav031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перейра, С. Ф., Госс, Л., Дворкин, Дж. (2011). Эукариотоподобные серин / треонинкиназы и фосфатазы у бактерий. Microbiol. Мол. Биол. Ред. 75, 192–212. DOI: 10.1128 / MMBR.00042-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перри, С.Э. и Эдвардс Д. Х. (2006). Белок Bacillus subtilis DivIVA имеет специфическую для споруляции близость к Spo0J. J. Bacteriol. 188, 6039–6043. DOI: 10.1128 / JB.01750-05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pini, F., De Nisco, N. J., Ferri, L., Penterman, J., Fioravanti, A., Brilli, M., et al. (2015). Контроль клеточного цикла с помощью главного регулятора CtrA в Sinorhizobium meliloti. PLoS Genet. 11: e1005232. DOI: 10.1371 / journal.pgen.1005232
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Помпео, Ф., Фулькье, Э., Серрано, Б., Гранжасс, К., и Галинье, А. (2015). Фосфорилирование белка деления клетки GpsB регулирует активность киназы PrkC через петлю отрицательной обратной связи в Bacillus subtilis . Мол. Microbiol. 97, 139–150. DOI: 10.1111 / mmi.13015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Prisic, S., Dankwa, S., Schwartz, D., Chou, M. F., Locasale, J. W., Kang, C. M., et al. (2010). Обширное фосфорилирование с перекрывающейся специфичностью с помощью сериновых / треониновых протеинкиназ Mycobacterium tuberculosis . Proc. Natl. Акад. Sci. США 107, 7521–7526. DOI: 10.1073 / pnas.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Равичандран А., Сугияма Н., Томита М., Сваруп С. и Исихама Ю. (2009). Анализ фосфопротеома Ser / Thr / Tyr патогенных и непатогенных видов Pseudomonas . Proteomics 9, 2764–2775. DOI: 10.1002 / pmic.200800655
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Равикумар В., Ши Л., Круг К., Деруиш А., Джерс К., Кузен К. и др. (2014). Количественный анализ фосфопротеома Bacillus subtilis выявляет новые субстраты киназы PrkC и фосфатазы PrpC. Мол. Клетка. Протеомика 13, 1965–1978. DOI: 10.1074 / mcp.M113.035949
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шмидль, С.Р., Гронау, К., Пьетак, Н., Хеккер, М., Бехер, Д., и Штюльке, Дж. (2010). Фосфопротеом минимальной бактерии Mycoplasma pneumoniae: анализ полного известного кинома Ser / Thr предполагает существование новых киназ. Мол. Клетка. Протеомика 9, 1228–1242. DOI: 10.1074 / mcp.M
7-MCP200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шехтер, Д., Костанцо, В., и Готье, Дж. (2004b). Регулирование репликации ДНК с помощью ATR: передача сигналов в ответ на промежуточные продукты ДНК. Ремонт ДНК 3, 901–908. DOI: 10.1016 / j.dnarep.2004.03.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, Л., Пиджено, Н., Равикумар, В., Добринич, П., Мацек, Б., Франжевич, Д., и др. (2014a). Кросс-фосфорилирование бактериальных серин / треониновых и тирозиновых протеинкиназ по ключевым регуляторным остаткам. Фронт. Microbiol. 5: 495. DOI: 10.3389 / fmicb.2014.00495
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, Л., Пижонно, Н., Вентру, М., Деруиш, А., Бидненко, В., Миякович, И. и др. (2014b). Сеть взаимодействия протеин-тирозинового фосфорилирования в Bacillus subtilis обнаруживает новые субстраты, активаторы киназ и перекрестное взаимодействие киназ. Фронт. Microbiol. 5: 538. DOI: 10.3389 / fmicb.2014.00538
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соарес, Н. К., Шпет, П., Круг, К., и Мацек, Б. (2013). Глобальная динамика протеома и фосфопротеома Escherichia coli во время роста на минимальной среде. J. Proteome Res. 12, 2611–2621. DOI: 10.1021 / pr3011843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суфи Б., Гнад Ф., Йенсен П. Р., Петранович Д., Манн М., Миякович И. и др. (2008). Фосфопротеом Ser / Thr / Tyr Lactococcus lactis IL1403 обнаруживает многократно фосфорилированные белки. Proteomics 8, 3486–3493. DOI: 10.1002 / pmic.200800069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Субраманян, В.В., Хохваген А. (2014). Сеть мейотических контрольных точек: шаг за шагом через профазу мейоза. Cold Spring Harb. Перспектива. Биол. 6: a016675. DOI: 10.1101 / cshperspect.a016675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, X., Ge, F., Xiao, C. L., Yin, X. F., Ge, R., Zhang, L.H., et al. (2010). Фосфопротеомный анализ показывает множественную роль фосфорилирования в патогенной бактерии Streptococcus pneumoniae . Дж.Proteome Res. 9, 275–282. DOI: 10.1021 / pr
2vPubMed Аннотация | CrossRef Полный текст | Google Scholar
Такахата, Ю., Иноуэ, М., Ким, К., Иио, Ю., Миямото, М., Масуи, Р. и др. (2012). Тесная близость сайтов фосфорилирования к лиганду в фосфопротеоме крайнего термофила Thermus thermophilus HB8. Протеомика 12, 1414–1430. DOI: 10.1002 / pmic.201100573
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танбихлер, М., и Шапиро, Л. (2006). MipZ, пространственный регулятор, координирующий сегрегацию хромосом с делением клеток у Caulobacter. Ячейка 126, 147–162. DOI: 10.1016 / j.cell.2006.05.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чыонг-Болдук, К. К., Динг, Ю., и Хупер, Д. К. (2008). Посттрансляционная модификация влияет на эффекты MgrA на экспрессию norA в Staphylococcus aureus . J. Bacteriol. 190, 7375–7381. DOI: 10.1128 / JB.01068-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Voisin, S., Watson, D.C., Tessier, L., Ding, W., Foote, S., Bhatia, S., et al. (2007). Цитоплазматический фосфопротеом грамотрицательной бактерии Campylobacter jejuni: доказательства модификации неидентифицированными протеинкиназами. Proteomics 7, 4338–4348. DOI: 10.1002 / pmic.200700483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райт, Д. П., и Улияш, А.Т. (2014). Регуляция транскрипции эукариотоподобными серин-треонинкиназами и фосфатазами у грамположительных бактериальных патогенов. Virulence 5, 863–885. DOI: 10.4161 / 21505594.2014.983404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, Л. Дж., И Эррингтон, Дж. (2003). RacA и система Soj-Spo0J объединяются для осуществления сегрегации полярных хромосом при спорулировании Bacillus subtilis . Мол. Microbiol. 49, 1463–1475. DOI: 10.1046 / j.1365-2958.2003.03643.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ксенопулос П. и Пиггот П. Дж. (2011). Регуляция роста материнской клетки и репликации хромосом во время споруляции Bacillus subtilis . J. Bacteriol. 193, 3117–3126. DOI: 10.1128 / JB.00204-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ядав Т., Карраско Б., Майерс А. Р., Джордж Н. П., Кек Дж. Л. и Алонсо Дж.С. (2012). Генетическая рекомбинация в Bacillus subtilis : разделение труда между двумя однонитевыми ДНК-связывающими белками. Nucleic Acids Res. 40, 5546–5559. DOI: 10.1093 / nar / gks173
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, М. К., Цяо, З. X., Чжан, В. Ю., Сюн, К., Чжан, Дж., Ли, Т. и др. (2013). Глобальный фосфопротеомный анализ показывает различные функции фосфорилирования серина / треонина / тирозина в модельной цианобактерии Synechococcus sp.штамм PCC 7002. J. Proteome Res. 12, 1909–1923. DOI: 10.1021 / pr4000043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зик, А., Лукач, М., Лим, В. А., и Ремени, А. (2009). Каркасы: платформы взаимодействия для сигнальных цепей клетки. Trends Cell Biol. 19, 364–374. DOI: 10.1016 / j.tcb.2009.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, X., Чжао, Ф., Гуань, X., Ян, Ю., Лян, К., и Цинь, С. (2007). Полногеномный обзор предполагаемых серин / треониновых протеинкиназ у цианобактерий. BMC Genomics 8: 395. DOI: 10.1186 / 1471-2164-8-395
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhu, H., Zhou, J., Ni, Y., Yu, Z., Mao, A., Hu, Y., et al. (2014). Вклад серин / треонинкиназы эукариотического типа в стрессовую реакцию и вирулентность Streptococcus suis. PLoS ONE 9: e91971. DOI: 10.1371 / journal.pone.0091971
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Методы обнаружения фосфорилирования белков: R&D Systems
Введение
Протеинкиназы переносят фосфатные группы с АТФ на остатки серина, треонина или тирозина на белково-пептидных субстратах, напрямую влияя на активность и функцию мишени. Исследования радиоактивных меток показывают, что примерно 30% белков в эукариотических клетках подвергаются фосфорилированию. 1, 2 Эта критическая посттрансляционная модификация регулирует широкий спектр клеточной активности, включая клеточный цикл, дифференцировку, метаболизм и нейронную связь.Кроме того, события аномального фосфорилирования вовлечены во многие болезненные состояния. При оценке фосфорилирования метод выбора может варьироваться в зависимости от многих факторов, включая конкретный задаваемый вопрос и доступность специализированного оборудования или реагентов. В этом обзоре дается краткое описание нескольких используемых в настоящее время методологий, а также рассматриваются некоторые преимущества и недостатки, связанные с каждой из них.
Анализы активности киназ
Протеинкиназы часто являются общими элементами во множестве сигнальных сетей, влияющих на многочисленные нижестоящие эффекторы, ответственные за биологический ответ.Таким образом, оценка активности одной конкретной киназы может предоставить ценную информацию о параллельных путях. 3 Активность киназы в биологическом образце обычно измеряется in vitro путем инкубации иммунопреципитированной киназы с экзогенным субстратом в присутствии АТФ. Измерение фосфорилированного субстрата определенной киназой можно оценить с помощью нескольких репортерных систем, включая колориметрическое (рис. 1), радиоактивное или флуорометрическое обнаружение. 4 Кроме того, R&D Systems предлагает нерадиоактивный универсальный набор для определения активности киназы, который позволяет количественно определять активность киназы для любой киназы, продуцирующей АДФ.Хотя информация может быть получена относительно действия конкретной киназы, оценка активности фермента в клеточных экстрактах дает только представление о сигнальном ландшафте. Мало что известно о модифицируемых белках, и анализы активности in vitro не учитывают роль потенциальной активности эндогенной фосфатазы. Прямое обнаружение фосфорилированных белков может обеспечить более подробный анализ клеточного ответа на внешний стимул, так как идентификация фосфопептида дает информацию об экспрессии и функциональном состоянии этого белка.
Разработка фосфоспецифических антител
Классический метод прямого измерения фосфорилирования белков включает инкубацию целых клеток с радиоактивно меченным 32 P-ортофосфатом, получение клеточных экстрактов, разделение белков с помощью SDS-PAGE и экспонирование на пленке. 2, 5 Этот трудоемкий метод требует многочасовых инкубаций и использования радиоизотопов. Другие традиционные методы включают двумерный гель-электрофорез, метод, который предполагает, что фосфорилирование изменит подвижность и изоэлектрическую точку белка.
В свете этих трудоемких методов разработка антител, зависимых от фосфорилирования, была долгожданным событием для исследователей. В 1981 году первые документально подтвержденные фосфо-антитела были получены у кроликов, иммунизированных бензонилфосфонатом, конъюгированным с гемоцианином лимфы улитки (KLH). Это антитело широко распознает белки, содержащие фосфотирозин. 6 Десять лет спустя антитела, специфичные для состояния фосфорилирования (фосфоспецифические), были разработаны путем иммунизации кроликов синтетическими фосфопептидами, представляющими аминокислотную последовательность, окружающую сайт фосфорилирования целевого белка. 7 Иммунную сыворотку наносили на пептидную аффинную колонку для получения высокоспецифичного иммунореагента. Доступность фосфо-специфических антител открыла дверь для улучшения традиционных методов, а также для разработки новых методов иммуноанализа (Просмотр фосфо-специфических антител). Основное предостережение при использовании фосфо-специфических антител в любом методе заключается в том, что успешное обнаружение зависит от специфичности и сродства антитела к интересующему фосфопротелину.
Вестерн-блот
Вестерн-блоттинг — это наиболее распространенный метод, используемый для оценки состояния фосфорилирования белка, и большинство лабораторий клеточной биологии имеют оборудование, необходимое для проведения этих экспериментов. После отделения биологического образца с помощью SDS-PAGE и последующего переноса на мембрану (обычно PVDF или нитроцеллюлозу) фосфоспецифические антитела можно использовать для идентификации представляющего интерес белка (Просмотр фосфоспецифических антител для Вестерн-блоттинга).Типичный протокол вестерн-блоттинга устраняет опасности и требования по удалению отходов, связанные с использованием радиоизотопов. Многие фосфоспецифические антитела весьма чувствительны и могут легко обнаружить фосфорилированный белок в стандартном образце (например, 10-30 мкг экстракта цельных клеток). Поскольку измеренные уровни фосфопротеина могут изменяться в зависимости от лечения или из-за ошибок загрузки геля, исследователи часто используют антитела, которые определяют общий уровень родственного белка (независимо от состояния фосфорилирования), чтобы определить фосфорилированную фракцию относительно общей фракции и служить в качестве внутреннего контроля загрузки (рис. 2).Часто используются как хемилюминесцентные, так и колориметрические методы обнаружения, и маркеры молекулярной массы также обычно используются для получения информации о массе белка. Подробный протокол вестерн-блоттинга можно найти на сайте www.RnDSystems.com/go/WesternBlotProtocol.
| Фигура 1. Фосфорилированный р53 в клетках СЕМ. СЕМ-клетки Т-лимфобласта человека подвергали воздействию УФ-С света. Клеточные экстракты, полученные через 30 или 60 минут после облучения, оценивали с помощью вестерн-блоттинга с использованием кроличьих поликлональных антител против человеческого фосфо-p53 (S15) (каталожный номер AF1043, верхняя панель) или козьих поликлональных антител против человеческого p53 (каталожный номер AF1355, нижняя панель).Указанные образцы обрабатывали лямбда-фосфатазой (лямбда-PPase). |
Иммуноферментный анализ (ELISA)
ELISA стал мощным методом измерения фосфорилирования белков. ELISA является более количественным, чем вестерн-блоттинг, и демонстрирует большую полезность в исследованиях, которые модулируют активность и функцию киназ. Формат этого анализа на основе микропланшетов обычно использует захватывающее антитело, специфичное для желаемого белка, независимо от состояния фосфорилирования.Целевой белок, очищенный или как компонент в сложном гетерогенном образце, таком как клеточный лизат, затем связывается с планшетом, покрытым антителами. Затем добавляют детектирующее антитело, специфичное для анализируемого сайта фосфорилирования. Эти анализы обычно разрабатываются с использованием колориметрического или флуориметрического детектирования. Интенсивность результирующего сигнала прямо пропорциональна концентрации фосфорилированного белка, присутствующего в исходном образце (рис. 3). Фосфоспецифический метод ELISA дает несколько преимуществ по сравнению с более традиционным иммуноблоттингом при измерении фосфорилирования белков.Во-первых, результаты легко поддаются количественной оценке с помощью калиброванного стандарта. Во-вторых, высокая специфичность возможна благодаря использованию двух антител, специфичных к целевому белку, используемых вместе в формате сэндвича. В-третьих, более высокая чувствительность, часто достигаемая с помощью ELISA, позволяет использовать меньшие объемы образцов и обнаруживать белки с низким содержанием. Наконец, формат на основе микропланшетов обеспечивает гораздо более высокую производительность, чем традиционный вестерн-блоттинг (View Surveyor IC ELISA Kits). ELISA обычно обеспечивает косвенное измерение активности киназы.Однако в вариациях описанной выше техники используется иммобилизованное захватывающее антитело, субстрат и метод обнаружения фосфо-субстрата для более прямых измерений киназной активности.
Рисунок 2. Фосфорилированный ERK1 / ERK2 в клетках NIH-3T3. Клетки NIH-3T3 обрабатывали 100 нг / мл человеческого PDGF (Каталожный № 120-HD) в течение 10 минут в присутствии или в отсутствие ингибитора MEK1 / 2 U0126 (Каталожный № 1144). После лизиса клеток фосфорилированные ERK1 и ERK2 были количественно определены с помощью набора Surveyor IC Immunoassay (Каталожный № SUV1018B).Результаты очень сопоставимы между результатами иммуноанализа Surveyor IC и количествами фосфорилированных ERK1 / ERK2 (каталожный номер AF1018) относительно общего количества ERK1 / ERK2 (каталожный номер MAB1576), обнаруженных с помощью вестерн-блоттинга (вставка). |
Клеточный ELISA
Хотя in vitro биохимические анализы киназы , такие как типичный сэндвич-ELISA, обычно используются для проверки гипотез и скрининга лекарств, они не могут воспроизвести внутриклеточную среду.Анализ фосфорилирования белков в интактных клетках может более точно отражать состояние конкретных сигнальных сетей. Недавно было разработано несколько иммуноанализов, позволяющих измерять фосфорилирование белка в контексте целой клетки. Клетки стимулируются, фиксируются и блокируются в одной лунке. Фосфоспецифические антитела используются для оценки статуса фосфорилирования с помощью флуориметрических (рис. 4) или колориметрических систем обнаружения. Кроме того, фосфо-белок и общий белок одновременно обнаруживаются в одной лунке микропланшета.Следовательно, сигналы, полученные от целевого белка, могут быть нормализованы к сигналам второго белка, корректируя вариации от лунки к лунке и позволяя точно оценивать и сравнивать уровни фосфобелка в нескольких образцах, аналогично использованию фосфо-специфических и общих белковые антитела в традиционном иммуноблоттинге. Эти анализы обходят необходимость создания клеточных лизатов и, следовательно, более поддаются высокопроизводительному анализу (View Cell-Based ELISA Kits).
Рисунок 3.Измерение фосфорилирования STAT1 (Y701) в клетках HeLa . ( A ) Клетки HeLa обрабатывали человеческим IFN-альфа A (Каталожный № 11100-1) в течение 20 минут. После фиксации клеток определяли фосфорилирование STAT1 (Y701) и нормализовали к общему STAT1 в той же лунке с использованием набора для ELISA на основе клеток Phospho-STAT1 (Y701) (Каталожный № KCB2894). Значения представляют собой среднее значение + для повторяющихся определений. Также показан анализ фосфорилированного STAT1 (№ по каталогу AF2894) и общего STAT1 (№ по каталогу MAB14901) вестерн-блоттингом (вставка A).( B ) Клетки HeLa предварительно обрабатывали в течение 30 минут ингибитором киназы Janus 2 (JAK2) SD-1008 (Каталожный № 3035), а затем либо оставляли нестимулированными, либо обрабатывали 2000 ед. / Мл IFN-альфа A в течение 20 минут. Фосфорилирование STAT1 (Y701) определяли, как в ( A ). |
Внутриклеточная проточная цитометрия и ICC / IHC
Традиционные методы внутриклеточной проточной цитометрии и иммуноцитохимии / иммуногистохимии (ICC / IHC) являются мощными инструментами для обнаружения событий фосфорилирования. 8, 9 В проточной цитометрии используется лазер для возбуждения флуорохрома, используемого для обнаружения антител. При оценке нескольких белков в одной ячейке необходимо тщательно выбирать наборы фильтров и флуорохромы с неперекрывающимися спектрами. Проточная цитометрия выгодна тем, что позволяет проводить быстрый количественный анализ отдельных клеток (рис. 5). 10 Белки могут быть обнаружены в клетках определенного типа в гетерогенной популяции с помощью фенотипирования маркеров клеточной поверхности без необходимости физического разделения клеток.Таким образом, небольшая редкая популяция клеток может быть проанализирована, не беспокоясь о потере клеток или изменении экспрессии белка, которое может произойти во время процесса сортировки клеток (просмотр фосфоспецифических антител для проточной цитометрии).
| Рисунок 4. Обнаружение IL-4-индуцированного фосфорилирования STAT6 с помощью внутриклеточной проточной цитометрии. Лимфобластоидные клетки Дауди человека ( A, ), необработанные или ( B ), активированные рекомбинантным человеческим ИЛ-4 (Каталожный № 204-ИЛ), фиксировали и повышали проницаемость с помощью метанола.Одновременное обнаружение (оранжевый) общего (ось x) и фосфорилированного (ось y) STAT6 было выполнено путем совместного окрашивания клеток с помощью конъюгированного с аллофикоцианином анти-STAT6 (Каталожный № IC2167A) и конъюгированного с фикоэритрином анти-фосфо-STAT6 (Каталожный № IC3717P ), соответственно. Процент клеток, положительных по фосфо-STAT6, указан для каждой обработки (вверху справа). Окрашивание контрольными изотипами (Каталожные № IC003A и № IC105P; бордовый) подчеркивает специфичность антител к STAT6. |
ICC обычно относится к обнаружению белка с помощью микроскопии в культивируемых клетках, тогда как IHC относится к обнаружению белка в срезах интактной ткани.Как и проточная цитометрия, эти методы позволяют оценивать множество белков в клетке или ткани при условии, что уделяется должное внимание, чтобы избежать перекрытия спектров флуоресценции или цвета. Обычно используются как флуоресцентные, так и колориметрические методы обнаружения (рис. 6). В отличие от других форматов для мониторинга фосфорилирования, ICC обычно является методом выбора для определения внутриклеточной локализации (Просмотр фосфо-специфических антител для ICC / IHC). И проточная цитометрия, и ICC / IHC требуют антител с высокой аффинностью и высокой специфичностью, этапов блокирования, контроля и титрования антител для исключения неоднозначных результатов из-за неспецифического связывания.
Для обнаружения фосфопротеинов с помощью проточной цитометрии и ICC требуется, чтобы белок был стабильным и доступным для антитела. Клетки обычно стимулируют и фиксируют формальдегидом или параформальдегидом, чтобы сшить фосфо-белки и стабилизировать их для анализа. Затем фиксированные клетки необходимо сделать проницаемыми, чтобы обеспечить проникновение фосфоспецифических антител в клетки. Различные методы пермеабилизации часто используются для различных субклеточных участков. Мягкий детергент позволит обнаруживать цитоплазматические белки, в то время как алкоголь может потребоваться для доступа антител к ядерным белкам.Проницаемость алкоголя может также улучшить обнаружение фосфобелков с использованием пептид-специфических антител из-за денатурирующих свойств спирта. 10 Для получения более подробной информации о протоколах ICC / IHC посетите наш веб-сайт по адресу www.rndsystems.com/protocol-types/iccihc-protocols.
| Рисунок 5. Обнаружение фосфорилированных белков с использованием ICC / IHC. Лимфобластоидные клетки Дауди человека обрабатывали (A), рекомбинантным человеческим IL-4 (каталожный № 204-IL) или (B), оставляли необработанными.Фосфорилированный STAT6 детектировали с использованием поликлонального антитела против фосфо-STAT6 человека (каталожный № AF3717) с последующим окрашиванием конъюгированным с NorthernLights ™ 557 козьим антикроличьим IgG (каталожный № NL004; красный) и окрашиванием ядра DAPI (синий). C: Фосфорилированный ERK1 / ERK2 был обнаружен в срезе воспаленной коры головного мозга крысы с использованием поликлональных антител против фосфо-ERK1 / ERK2 человека / мыши / крысы (№ по каталогу AF1018). Ткань окрашивали с помощью набора для окрашивания клеток и тканей против HRP-DAB кролика (Каталожный № CTS005; коричневый) и контрастировали гематоксилином (синий). |
Масс-спектрометрия
Всесторонняя оценка фосфорилирования белков (фосфопротеомики) в сложных биологических образцах, таких как клеточные лизаты, важна для понимания сигнальных сетей, основанных на фосфорилировании. Крупномасштабный анализ фосфо-белков в сложных белковых смесях включает идентификацию фосфо-белков и фосфопептидов и секвенирование фосфорилированных остатков. Методы масс-спектрометрии (МС) являются полезными инструментами для решения этих задач.Хотя МС можно использовать с превосходной чувствительностью и разрешением для идентификации одного белка, существует несколько трудностей, присущих анализу фосфо-белков. Во-первых, сигналы от фосфопептидов, как правило, слабее, поскольку они заряжены отрицательно и плохо ионизируются МС с электрораспылением, который выполняется в положительном режиме. 11 Во-вторых, может быть трудно наблюдать сигналы от представляющих интерес фосфо-белков с низким содержанием на высоком фоне большого количества нефосфорилированных белков.Чтобы преодолеть эти недостатки, было разработано несколько стратегий обогащения для анализа фосфобелков с помощью МС, включая аффинную хроматографию с иммобилизованным металлом (IMAC), обогащение фосфоспецифических антител 12 , методы на основе химической модификации 13 , такие как бета-элиминация фосфора -серин и -реонин, 14 и замена фосфатной группы биотинилированными фрагментами. 15
Профилирование нескольких аналитов
Масс-спектрометрические методы, такие как диссоциация, вызванная столкновениями (CID) и диссоциация с переносом электрона (ETD), обеспечивают всесторонний параллельный анализ пептидных последовательностей и посттрансляционных модификаций, таких как фосфорилирование. 16 Эти методы трудозатратны, и стратегии комплексного анализа фосфорилирования могут не потребоваться, если конкретные пути представляют основной интерес. Это привело к разработке нескольких новых методов измерения фосфорилирования белков одновременно нескольких аналитов. Как правило, они включают использование фосфо-специфических антител и включают форматы обнаружения на основе микропланшетов (View Proteome Profiler 96 Antibody Arrays) и на основе мембран (View Proteome Profiler Antibody Arrays) (вставка 1, рисунки 7 и 8). 17, 18 Очевидное преимущество этих анализов состоит в том, что пропускная способность значительно повышается за счет исключения необходимости проведения нескольких отдельных вестерн-блоттингов или традиционных анализов на основе ELISA. Эти методы также известны тем, что предоставляют больше данных, но требуют очень небольшого объема выборки. В торговле анализы профилирования белков обычно считаются менее чувствительными, чем их более традиционные аналоги, из-за потенциальной перекрестной реактивности антител.
Мультиплексный анализ фосфо-протеина
Наши массивы фосфо-специфических антител преобладают в первичной литературе
Данные наших массивов фосфо-антител опубликованы в высокоэффективных журналах *
* Избранные ссылки
| Новый профилировщик протеома на основе микропланшетов96 Массивы фосфо-антител Характеристики
** Индивидуальные наборы доступны только в формате хемилюминесцентного обнаружения | ||||||||||||||||||||||||||||||||||||||||||||||||
Рисунок 6. Обнаружение фосфорилирования киназы MAP. Лизаты из клеток HeLa (20 мг / лунка), которые не были обработаны или подвергались воздействию 150 Дж / м 2 УФ-света с последующим 30-минутным периодом восстановления, были протестированы с использованием Proteome Profiler 96 Human Phospho-Kinase Array 1 Комплект (Каталожный № ARZ004).Сигналы массива анализировали с использованием программного обеспечения для анализа изображений Q-View. Показаны перевернутые изображения лунок ( A, ) со средней плотностью пикселей на вертикальных столбчатых диаграммах ( B ). Клетки MCF-7 либо не обрабатывали, либо обрабатывали 100 нг / мл человеческого IGF-I (Каталожный № 291-G1) в течение 1 часа; клетки, которые получали IGF-I, были либо предварительно обработаны, либо нет ингибитором PI3K LY294002 (Каталожный № 1130) ( C ). Сигналы массивов анализировали с использованием программного обеспечения для анализа изображений Q-View. Показаны перевернутые изображения лунок ( C ) со средней плотностью пикселей на вертикальных столбчатых диаграммах ( D ).(RS = контрольная точка). |
Рис. 7. Влияние ингибитора MEK1 / 2 U0126 на путь ERK. ( A ) Proteome Profiler Массив человеческого фосфо-MAPK (№ по каталогу ARY002B) инкубировали с лизатами клеток HeLa, необработанных или обработанных PMA, в присутствии или в отсутствие U0126 (№ по каталогу 1144). ( B ) Графическое представление данных. |
Заключение
Оценка фосфорилирования белков часто является важным компонентом репертуара клеточных биологов для понимания внутриклеточных факторов, лежащих в основе клеточной активности.Учитывая важную роль киназ, исследователям крайне важно иметь качественные инструменты для измерения фосфорилирования белков и / или активности киназ. Каждый метод отличается от других в разных контекстах, и необходимо тщательно выбирать метод, который лучше всего соответствует плану эксперимента (таблица 1). Этот обзор дает краткое представление о некоторых из наиболее широко используемых методов оценки фосфорилирования белков. Из-за растущего спроса методологии продолжают совершенствоваться, приближая исследователей к пониманию этих сложных и важных процессов, которые в конечном итоге контролируют клеточную функцию.
| Таблица 1. Методы , используемые для обнаружения фосфорилирования белка с использованием фосфоспецифических антител: Относительное сравнение продуктов, предлагаемых R&D Systems. | ||||||||
| Заявка | Количественный | Полу- Количественный | Высокая чувствительность | Анализ отдельных клеток | Локализация белка | Мульти- Анализ аналитов | Двойной обнаружение из общего числа и фосфо — белок | Интенсивный труд |
| Вестерн-блот | Х | Х | + | |||||
| ELISA | Х | Х | +/- | |||||
| ELISA на клеточной основе | Х | Х | Х | – | ||||
| Внутриклеточная проточная цитометрия | Х | Х | Х | Х | +/- | |||
| Иммуноцитохимия | Х | Х | + | |||||
| Масс-спектрометрия | Х | Х | Х | Х | + | |||
| Профилировщик протеома | Х | Х | – | |||||
Ссылки
- Сефтон, Б.М. и С. Шеноликар (1996) Анализ фосфорилирования белков. В Осубеле Ф. et al. (ред.): Current Protocols in Molecular Biology, New York: John Wiley & Sons, Inc. 18.1.1-18.1.5.
- Уберсакс, Дж. А. И Дж. Э. Феррелл (2007) Nat. Преподобный Мол. Cell Biol. 8 : 530.
- Ni, Q. et al. (2006) Методы 40 : 280.
- Джонсон, С.А. и Т. Хантер (2005) Nat. Методы 2 : 17.
- де Граау, М. et al. (2006) Электрофорез 27 : 2676.
- Ross, A.H. et al. (1981) Nature 294 : 654.
- Черник, А.Дж. et al. (1991) Methods Enzymol. 201 : 264.
- Zell, T. et al. (2001) Proc. Natl. Акад. Sci. США 98 : 10805.
- Willinger, T. et al. (2005) J. Immunol. 175 : 5895.
- Круцик, П.О. et al. (2004) Clin. Иммунол. 110 : 206.
- Mann, M. et al. (2002) Trends Biotechnol. 20 : 261.
- Brill, L.M. et al. (2004) Анал. Chem. 76 : 2763.
- Steen, H. et al. (2002) J. Biol. Chem. 277 : 1031.
- Zhou, H. et al. (2001) Нац. Biotechnol. 19 : 375.
- Oda, Y. et al. (2001) Нац. Biotechnol. 19 : 379.
- Molina, H. et al. (2007) Proc. Natl. Акад. Sci. США 104 : 2199.
- Stiehl, D.P. et al. (2012) Онкоген 31 : 2283.
- Bai, Y. et al. (2012) Cancer Res. 72 : 2501.
Специальный выпуск: фосфорилирование белков и передача сигналов клетками
Уважаемые коллеги,
Фосфорилирование — одна из наиболее важных и наиболее часто встречающихся посттрансляционных модификаций белков.Фосфорилирование белков играет решающую роль в передаче клеточных сигналов в ответ на внеклеточные стимулы и имеет фундаментальное значение в биологической регуляции.
Фосфорилирование белков контролируется протеинкиназами и протеинфосфатазами. Протеинкиназа — это фермент киназа, который модифицирует другие молекулы, в основном белки, путем химического добавления к ним фосфатных групп (фосфорилирование). Геном человека содержит около 518 генов протеинкиназ, и они составляют около 2% всех генов человека.Белок может фосфорилироваться по трем аминокислотам, включая тирозин (Tyr, Y), серин (Ser, S) и треонин (Thr, T). Протеиновая фосфатаза — это фермент фосфатаза, который удаляет фосфатную группу из фосфорилированного аминокислотного остатка своего белка-субстрата. В то время как в геноме человека имеется 107 генов, которые кодируют протеинтирозинфосфатазу, серин / треонинфосфатаз всего несколько.
До 30% всех белков человека могут быть модифицированы протеинкиназой и фосфатазой.Фосфорилирование и дефосфорилирование обычно действуют как переключатель, включающий и выключающий сигнальный каскад. Фосфорилирование белка обычно приводит к функциональному изменению целевого белка (субстрата) за счет изменения активности фермента, клеточного местоположения или ассоциации с другими белками, что часто приводит к изменениям биологической функции клетки.
Этот специальный выпуск будет охватывать последние достижения во всех областях, связанных с фосфорилированием белков и передачей сигналов в клетках.Приветствуются как оригинальные исследовательские статьи, так и обзоры.
Проф. Чжисян Ван
Приглашенный редактор
Информация для подачи рукописей
Рукописи должны быть представлены онлайн по адресу www.mdpi.com, зарегистрировавшись и войдя на этот сайт. После регистрации щелкните здесь, чтобы перейти к форме отправки. Рукописи можно подавать до установленного срока. Все статьи будут рецензироваться. Принятые статьи будут постоянно публиковаться в журнале (как только они будут приняты) и будут перечислены вместе на сайте специального выпуска.Приглашаются исследовательские статьи, обзорные статьи, а также короткие сообщения. Заголовок и краткую аннотацию (около 100 слов) планируемых статей можно отправить в редакцию для объявления на этом сайте.
Представленные рукописи не должны были публиковаться ранее или рассматриваться для публикации в другом месте (за исключением трудов конференции). Все рукописи проходят тщательное рецензирование путем простого слепого рецензирования. Руководство для авторов и другая важная информация для подачи рукописей доступна на странице Инструкции для авторов. Cells — это международный рецензируемый ежемесячный журнал с открытым доступом, публикуемый MDPI.
Пожалуйста, посетите страницу Инструкций для авторов перед отправкой рукописи. Плата за обработку статьи (APC) для публикации в этом журнале с открытым доступом составляет 2000 швейцарских франков. Представленные документы должны быть хорошо отформатированы и написаны на хорошем английском языке. Авторы могут использовать MDPI Услуги редактирования на английском языке перед публикацией или во время редактирования автора.
Фосфорилирование белков — Creative Diagnostics
Обзор фосфорилирования белков
Фосфорилирование — наиболее распространенный и важный молекулярный механизм острой и обратимой регуляции функции белков.Благодаря фосфорилированию белка функция белка регулируется в ответ на внеклеточные стимулы как внутри, так и вне клетки. Фосфорилирование белков обычно анализируется путем биосинтетического мечения с помощью 32 P-меченого неорганического фосфата ( 32 P i ), а исследования клеток млекопитающих, метаболически меченных ортофосфатом 32 P, предполагают, что до одной трети все клеточные белки ковалентно модифицируются фосфорилированием белков.Было обнаружено, что большинство белков фосфорилируется по остаткам серина или треонина, и многие белки, участвующие в передаче сигнала, также фосфорилируются по остаткам тирозина. Многие протеинкиназы обладают строгой специфичностью к фосфорилированию остатков серина / треонина или тирозина. Из-за большого количества киназ и фосфатаз в геноме идентификация конкретных ферментов, ответственных за данный сайт в данном белке, является чрезвычайно сложной задачей. Однако, поскольку протеинкиназы и фосфатазы распознают детерминанты локальной специфичности в белках, можно использовать небольшие пептиды для изучения характеристик сайт-специфического фосфорилирования.Кроме того, фосфорилирование обычно вызывает задержку подвижности геля, что дает возможность исследовать фосфорилирование и дефосфорилирование пептидов путем мониторинга миграции на пептидных гелях высокого разрешения.
Процесс и регулирование фосфорилирования белков
Фосфорилирование белков участвует в регуляции широкого спектра клеточных процессов и состояний. Состояние фосфорилирования белков в типичных эукариотических клетках в основном определяется активностью протеинкиназ и фосфатаз на их субстратах.Ковалентная конъюгация фосфатных групп с пептидами часто изменяет функцию белка, вызывая конформационные изменения в белках или влияя на взаимодействия белок-белок / фермент-субстрат. Многие киназы и фосфатазы также являются субстратами фосфорилирования, образуя таким образом взаимозависимые и иерархически регулируемые сигнальные петли и каскады. Большинство полипептидных факторов роста (фактор роста тромбоцитов и эпидермальный фактор роста являются одними из наиболее изученных) и цитокинов (например,g., интерлейкин 2, колониестимулирующий фактор 1 и интерферон гамма) стимулируют фосфорилирование при связывании со своими рецепторами.
Несколько сигнальных путей, критически вовлеченных в эмбриональное развитие и модуляцию экспрессии генов, инициируются активацией рецепторов фактора роста клеточной поверхности, которые представляют собой известные рецепторные тирозинкиназы (RTK), таких как рецептор фактора роста фибробластов (FGFR) и фактор роста инсулина. 1 (IGF-1R) или рецептор серин / треонинкиназ (например,g., TGF-βR и BMPR1 / 2). После связывания лиганда эти рецепторные киназы полностью активируются и фосфорилируют нижестоящие внутриклеточные киназы для инициирования сигнальных каскадов фосфорилирования, которые часто регулируют транслокацию и активность нескольких факторов транскрипции (например, белков Myc, β-катенин и Smad) и экспрессию дифференцировки. -связанные гены.
Индуцированное фосфорилирование также активирует цитоплазматические протеинкиназы, такие как Raf, активаторы митоген-активированных протеинов (MAP) киназ Erk1 / 2 и MEK1 / 2, принадлежащих сигнальному пути Ras-Raf-MEK-ERK, и фосфатидилинозитол 3 ‘. -киназа-активированная киназа (PI3K), протеинкиназа B / Akt.Эти пути передачи сигналов сильно взаимодействуют друг с другом и находятся под влиянием других протеинфосфатаз, включая PTEN и PTPN11 (Shp2), которые негативно контролируют фосфорилирование белка, а также играют критическую роль в модуляции этой сигнальной сети и клеточной биологии.
Важность фосфорилирования белков
Фосфорилирование белков играет важную роль практически во всех аспектах клеточной биологии. Было показано, что сборка митотического веретена требует точной регуляции динамики микротрубочек, что во многом достигается за счет согласованной работы различных типов протеинкиназ и фосфатаз.Несмотря на то, что серин / треонин-специфические, двойные и тирозин-протеинфосфатазы участвуют в регуляции динамики микротрубочек, они имеют разные, неперекрывающиеся функции. Согласно экспериментальным данным, роль фосфатаз в регуляции цитоскелета обычно связана с серин / треонин-специфическими протеинфосфатазами: PP1, PP2A (как каталитические, так и регуляторные субъединицы), PP4 (PPX), PP6 и PP7. Дифференциация и развитие также контролируются фосфорилированием.
Дефосфорилирование белков также играет жизненно важную роль в регуляции функции белков. Обратимое фосфорилирование белков во время клеточного цикла является ключевым регуляторным механизмом организации, динамики цитоскелета, а также дифференцировки и деления клеток. В настоящее время существует множество экспериментальных данных в пользу роли различных протеинкиназ как ключевых регуляторов цитоскелета и деления клеток. Ряд ингибиторов протеинкиназ с разной специфичностью применялся в лабораторных экспериментах и в медицине.
Артикул:
| 1. | Нестлер, Э.Дж .; Грингард, П. Основы нейрохимии: молекулярные, клеточные и медицинские аспекты. 6 -е издание . 1999 г. |
| 2. | Лоринг, Дж. Ф .; и др. . Посттрансляционные модификации белков и регуляция плюрипотентности в стволовых клетках человека. Клеточные исследования .2014, 24: 143-160. |
Вернуться к ресурсам
Twitter Facebook
| Описание: Альфа-синуклеин экспрессируется главным образом в центральной нервной системе (головном мозге), но также в низких концентрациях экспрессируется в различных тканях, кроме печени. Он преимущественно экспрессируется в неокортексе, гиппокампе, черной субстанции, таламусе и мозжечке ЦНС.Это в первую очередь нейрональный белок, но его также можно найти в нейроглиальных клетках. Он сконцентрирован в пресинаптических нервных окончаниях нейронов, а также имеет ядерную и митохондриальную локализацию. Альфа-синуклеин взаимодействует с фосфолипидами плазматической мембраны. Альфа-синуклеин в растворе считается внутренне неупорядоченным белком и поэтому не имеет стабильной вторичной или третичной структуры. Однако данные свидетельствуют о наличии частичных альфа-спиральных, а также бета-листовых структур, а также в основном структурированных тетрамерных состояний в растворе, равновесие которых может быть изменено партнерами по связыванию. Белок альфа-синуклеина человека состоит из 140 аминокислот, кодируемых геном SNCA. Первичная структура разделена на три отдельных домена: (1-60) — амфипатическая N-концевая область, в которой преобладают четыре повтора из 11 остатков, включая консенсусную последовательность KTKEGV. Эта последовательность имеет структурную склонность к альфа-спирали, подобную доменам связывания аполипопротеинов. (61-95) — центральная гидрофобная область, которая включает область неамилоидного β-компонента (NAC), участвующую в агрегации белка.(96-140) — очень кислая и богатая пролином область. По крайней мере, три изоформы синуклеина продуцируются посредством альтернативного сплайсинга. Наиболее распространенная форма белка — это полный транскрипт длиной 140 аминокислот. Другие изоформы представляют собой альфа-синуклеин-126, лишенные остатков 41-54; и альфа-синуклеин-112, в котором отсутствуют остатки 103-130. α-синуклеин может участвовать в регуляции высвобождения и транспорта дофамина, а также может вызывать фибрилляцию тау-белка, ассоциированного с микротрубочками. альфа-синуклеин действует как молекулярный шаперон при образовании комплексов SNARE.В частности, он может связываться с фосфолипидами плазматической мембраны и с синаптобревином-2 через свой С-концевой домен, чтобы влиять на синаптическую активность. альфа-синуклеин необходим для нормального развития когнитивных функций и значительно взаимодействует с тубулином. Он также снижает реакцию нейронов на различные апоптотические стимулы, что приводит к снижению активации каспазы-3. Фибриллы альфа-синуклеина являются основным заместителем внутриклеточных телец Леви, наблюдаемых при болезни Паркинсона. Фосфорилирование CK1, по-видимому, происходит по остаткам, отличным от остатка, фосфорилированного другими киназами.Фосфорилирование Ser-129 является избирательным и обширным при синуклеинопатических поражениях. In vitro фосфорилирование по Ser-129 способствует образованию нерастворимых фибрилл. Фосфорилируется по Tyr-125 посредством PTK2B-зависимого пути при осмотическом стрессе. |



 Эти белки-мишени становятся субстратами для определенных лигаз убиквитина Е3 только тогда, когда они фосфорилируются.
Эти белки-мишени становятся субстратами для определенных лигаз убиквитина Е3 только тогда, когда они фосфорилируются.
